從病毒詭變特性與免疫機制談起
陳怡寧/臺大獸醫系學、碩士,普渡大學比較病理學博士,現為中原大學生物科技系副教授

今年(2020 年)的年夜飯很不平靜,一株新型的冠狀病毒從中國武漢逐漸蔓延到全世界,截至三月,全球上百個國家累積超過 30 萬件 2019 冠狀病毒疾病(Coronavirus disease 2019, COVID-19)確診案例,造成 1 萬多人死亡,死亡率達 4.3%。而 17 年前引發 SARS 的冠狀病毒(SARS-CoV)則是從中國廣東擴散到全球其他 27 個國家,共有 8096 個確診案例,造成 774 個人死亡,死亡率達 9.56%。
儘管病毒來勢洶洶,不過從當初 SARS 爆發以來所累積的科學知識及技術讓科學家在極短時間內就將此新型冠狀病毒的全基因序列解出,啟動全球性治療藥品及疫苗的研發及測試。比較資料庫所有冠狀病毒的基因序列後發現與 SARS-CoV 有 79% 的相似度,因此,國際病毒分類委員會(International Committee on Taxonomy of Viruses, ICTV)將此新型冠狀病毒正式命名為 SARS-CoV-2。
SARS-CoV-2 是第七種感染人類冠狀病毒,其他六種包括死亡率高達 36% 的中東呼吸道症候群(middle East respiratory syndrome, MERS)冠狀病毒、SARS-CoV 及其他四種會造成普通感冒且常合併發生呼吸道及胃腸道症狀的病毒,分別為人類冠狀病毒 229E、NL63、OC43 和 HKU1。
感染動物的冠狀病毒
冠狀病毒是一群感染不同動物及引起各種不同疾病的病毒。最早被發現的冠狀病毒是在 1930 年代造成雞隻呼吸道發炎及腎臟疾病的傳染性支氣管炎病毒(avian infectious bronchitis virus, IBV),之後陸續發現造成小鼠肝炎及去髓鞘性腦炎的小鼠肝炎病毒(murine hepatitis virus)、狗急性腸道炎的犬冠狀病毒(canine coronavirus)及貓傳染性腹膜炎的貓冠狀病毒(feline infectious peritonitis virus, FIPV)。
另外,目前有五種冠狀病毒會造成豬隻生病,包括 1960 年代在歐洲發現的豬隻傳染性胃腸炎病毒(transmissible gastroenteritis virus, TGV)及豬血凝性腦脊隨炎病毒(hemagglutinating encephalomyelitis virus, HEV)、1970 年代在歐洲發現的豬流行性下痢病毒(porcine epidemic diarrhea virus, PEDV)、2014 年在美國發現的豬丁型冠狀病毒(porcine coronavirus HKU15)及 2016 年在中國廣東發現的新型豬腸道甲型冠狀病毒(swine enteric alphacoronavirus, SeACoV)。
其實,獸醫們面對冠狀病毒威脅動物們的健康已有近 90 年的歷史,一直以來,隔離、清除被病毒感染的動物,徹底消毒、清空的動物房舍,嚴密的生物安全措施都是唯一對抗冠狀病毒疾病最有效的方式。雖然至今沒有治療的藥物,但有針對犬、貓、雞跟豬的冠狀病毒疫苗可以保護動物不被感染或降低疾病的嚴重程度。
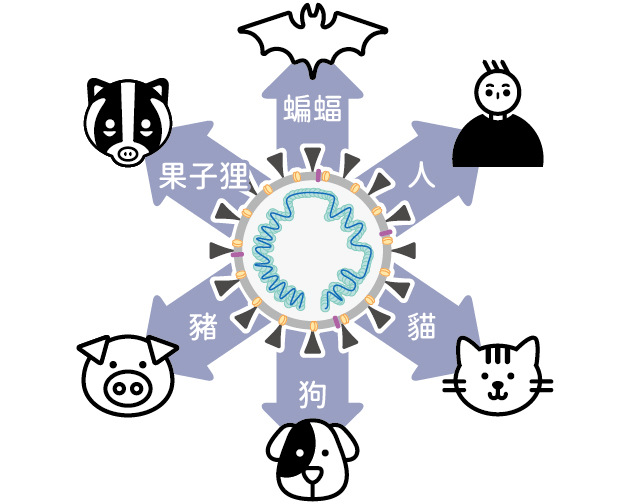
▲ 冠狀病毒可感染人類及多種動物。
冠狀病毒的進化
病毒是介於生命及非生命之間的族群,一般只由蛋白質及核酸所構成,感染細胞後才能靠細胞複製病毒的核酸及產生病毒的蛋白質,然後新產生的病毒蛋白及核酸再重新組合成新的病毒顆粒,離開感染的舊細胞,感染更多新的細胞。人類及其他動物細胞內會有保存遺傳訊息的去氧核醣核酸(deoxyribonucleic acid, DNA)在細胞核中,且會在細胞分裂時利用 DNA 聚合酶(DNA polymerase)進行複製新的一組 DNA 到新的細胞中,為了確保遺傳訊息的正確性,DNA 聚合酶跟其他細胞酵素有非常嚴謹的品質確認及矯正機制。
另外,當動物細胞要產生蛋白質時,細胞核中的 DNA 會由核糖核酸聚合酶(ribonucleic acid polymerase, RNA polymerase)轉錄(transcription)成訊息 RNA,然後進入細胞質內轉譯(translation)成蛋白質。一般來說,病毒只會攜帶 DNA 或 RNA 一種核酸,像天花病毒及 B 型肝炎病毒就屬於 DNA 病毒,而冠狀病毒、流行性感冒病毒及腸病毒等都屬於 RNA 病毒。攜帶 DNA 的病毒需要進入感染細胞的細胞核中進行複製,而 RNA 病毒則可以直接在感染細胞的細胞質中利用 RNA 病毒特有的 RNA 聚合酶進行複製。複製過程中,RNA 病毒特有的 RNA 聚合酶可以直接使用 RNA 當作複製模板,不像動物細胞的RNA 聚合酶是使用 DNA 當作轉錄訊息 RNA 的模板。另外,RNA 病毒的 RNA 聚合酶也沒有動物細胞 DNA 聚合酶進行複製的品質確認及矯正機制,所以複製時會產生很多的變異。
冠狀病毒是最大的 RNA 病毒,全基因長度有 26000~32000 個核苷酸(nucleotide),表示每次複製產生變化的核苷酸數目也比其他病毒多,也可以預見長期演化下產生多變且複雜的冠狀病毒群。除了複製產生的突變外,冠狀病毒在產生蛋白質過程中會形成多片段的訊息 RNA,當同一個體感染多種冠狀病毒時,這些訊息 RNA 片段就有機會進行重組交換,形成新型的冠狀病毒。利用複製突變(mutation)及基因交換重組(genetic recombination)的機制,使原本無法感染人類的冠狀病毒可能因此能辨認人類細胞表面的受體而感染人類。
冠狀病毒如何跨物種感染?
冠狀病毒在電子顯微鏡(electron microscope)下為帶有皇冠的多變球狀,而形成皇冠結構的是冠狀病毒的棘蛋白(spike glycoprotein, S),負責辨認細胞表現的受體。一旦冠狀病毒的棘蛋白可以辨認並與細胞受體結合後,冠狀病毒就可以進入細胞。而進入細胞的病毒數量和病毒是否能有效使用細胞的核酸複製及蛋白質轉譯系統,也會決定冠狀病毒是否能順利感染細胞並產生大量新的病毒來感染更多細胞。不同的冠狀病毒可辨認使用的細胞受體不同,目前研究就發現至少 4 種蛋白質可以當作冠狀病毒的細胞受體。SARS-CoV 及 SARS-CoV-2 可辨認的細胞受體是血管收縮素轉化酶 II(angiotensin converting enzyme II, ACE2),而人類與動物細胞表面的 ACE2 有少數胺基酸的不同,只有能辨認人類 ACE2 的冠狀病毒才能感染人類,如 SARS-CoV 及 SARS-CoV-2,而貓冠狀病毒等其他動物的冠狀病毒因為無法辨認人類的細胞受體便無法感染人類。
由於冠狀病毒棘蛋白與細胞受體的結合關係決定冠狀病毒能感染的物種特異性,因此若遺傳突變或基因重組改變冠狀病毒的棘蛋白,就會讓冠狀病毒產生跨物種感染的能力。以 SARS-CoV 為例,研究顯示廣東野生動物市場的果子狸(即臺灣的白鼻心)身上帶有幾乎與人類 SARS-CoV 一模一樣的果子狸 SARS 冠狀病毒,兩種冠狀病毒都可以使用人類的細胞受體 ACE2。然而,擴大調查後發現野生的果子狸並不攜帶 SARS 冠狀病毒,反而是在菊頭蝠(即臺灣的蹄鼻蝠)身上發現類似的蝙蝠 SARS 冠狀病毒。蝙蝠 SARS 冠狀病毒並不能使用人類的細胞受體 ACE2,但是可以使用蝙蝠及果子狸的細胞受體,代表蝙蝠 SARS 冠狀病毒能從蝙蝠跳到果子狸身上。
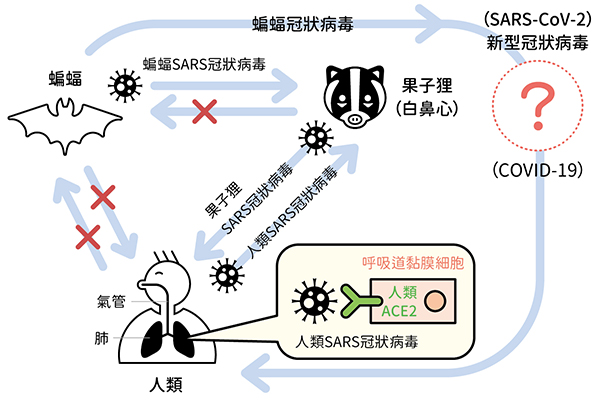
▲ SARS 與 COVID-19 可能傳播途徑。
所以,推測是野生動物市場的果子狸接觸到蝙蝠 SARS 冠狀病毒,因為野生動物市場環境惡劣,病毒在免疫系統虛弱的果子狸身上大量複製,然後傳染給跟果子狸長期接觸的動物飼養員及廚師等,最後造成大流行。
在發現 SARS 冠狀病毒的可能產生途徑後,中國大陸科學家持續調查中國各地的蝙蝠是否攜帶冠狀病毒,結果發現多種菊頭蝠種類族群都帶有類似的蝙蝠 SARS 冠狀病毒,這些病毒的基因序列變異度很大,有些只能使用蝙蝠的細胞受體 ACE2,而少數竟然已經變化到可以使用蝙蝠及人類的細胞受體 ACE2 了,表示這些少數的蝙蝠 SARS 冠狀病毒有潛力感染人類。因此,確保這些蝙蝠留在野外,不跟人類接觸就變得非常重要。
這次造成全球大流行的 SARS-CoV-2 來自哪裡,產生的途徑是什麼都還需未來更多的調查。雖然中國科學家曾經在某隻菊頭蝠身上偵測到與 SARS-CoV-2 基因序列有 96% 相似性的冠狀病毒,但更重要的是去了解這病毒是如何及什麼時候入侵人類。
遭受病毒感染後體內的免疫反應
病毒感染細胞後可以直接破壞細胞或改變細胞的生理功能導致細胞的病變及死亡。當病毒進入細胞後,細胞內的感應蛋白會偵測到病毒的存在,進一步活化細胞產生細胞激素的機制。這些細胞激素就像戰爭的傳令兵,從感染細胞釋放出來後告知其他健康細胞病毒入侵的訊息,並跑到鄰近的淋巴結聯絡其他免疫細胞以活化全身的免疫反應。病毒感染細胞最先產生的細胞激素是干擾素(interferon, IFNs),會刺激旁邊未被病毒感染的細胞提高抵抗病毒的能力,也會進一步活化 B 細胞(B cell)及 T 細胞(T cell)。
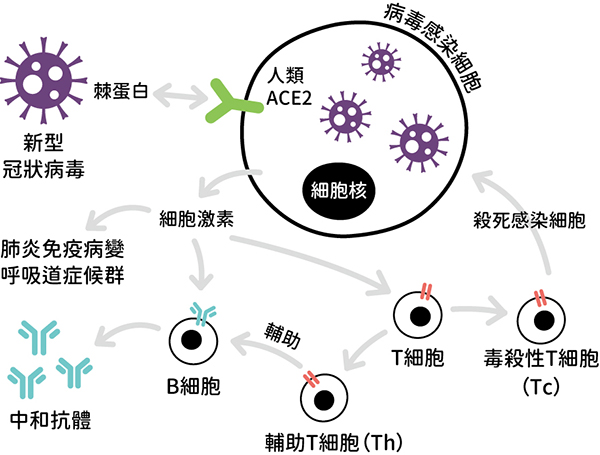
▲冠狀病毒引起的免疫反應。
B 細胞主要產生可以辨認病毒的抗體,其中可以跟病毒結合並阻擋病毒感染細胞的抗體被稱為中和抗體,是施打疫苗後主要提供保護能力的免疫反應,稱為抗體免疫。T 細胞主要可分為兩群,一群是輔助型 T 細胞(T helper cells, Th),可以協助 B 細胞產生抗體,另一群是毒殺性 T 細胞(cytotoxic T cell, TC),主要是直接殺死被病毒感染的細胞,稱為細胞免疫。如果疫苗也能活化細胞免疫,通常產生的抗體也會較多較強,這種疫苗的保護效果也會比只刺激抗體產生免疫的疫苗來得更好。
冠狀病毒比較複雜的是某些冠狀病毒感染後會過度活化免疫反應,過多的細胞激素(cytokine)釋放出來後刺激全身的血管擴張,白血球聚集造成嚴重的發炎反應,稱為細胞激素風暴(cytokine storm)。像 SARS 及 COVID-19 就是在肺臟造成嚴重的發炎反應,組織液經由擴張的血管進入原本充滿空氣的肺泡,造成肺泡無法進行空氣交換,使受感染病患無法獲得生存所需的氧氣,最後窒息或因缺氧導致多重器官衰竭死亡。
冠狀病毒疫苗的開發
過去針對 SARS-CoV 的疫苗研究發現,接種過 SARS-CoV 疫苗的小鼠在暴露到 SARS-CoV 後會發生過度的免疫反應而產生病變,因此不得不停止這種疫苗的研發。所以,成功的人類冠狀病毒疫苗不只要產生可以抑制病毒感染的免疫反應,更要避免因為過度免疫反應所產生的副作用。
COVID-19 的疫情持續延燒,對疫苗的需求是日漸緊迫。雖然傳統利用大量增殖病毒後產生減毒或去活化病毒疫苗的速度非常快,但像 SARS-CoV 及 SARS-CoV-2 這種危險病毒需要生物安全第三等級(BSL-3)以上的負壓硬體才能增殖,不但生產硬體上有困難也有病毒汙染環境及操作人員的潛在危險性。
現在的研究主要以生產冠狀病毒蛋白質或核酸為主要成分的疫苗,但目前仍需針對疫苗效力及安全性進行動物實驗及人體試驗的完整評估。未來證實有效的人類冠狀病毒疫苗,首先必須要確認沒有產生免疫病變的危險,然後必須提供有效的中和抗體濃度以阻擋病毒感染,最後,則要能對付持續改變的冠狀病毒方能提供足夠的保護力。
延伸閱讀:
Gallagher T. and Perlman S., Public health: Broad reception for coronavirus, Nature, Vol. 495(7440): 176-7, 2013.
本文轉載自《科學月刊》第604期〈為什麼冠狀病毒疫苗難以研發?從病毒詭變特性與免疫機制談起〉。
藥來救命——對抗冠狀病毒的藥物開發策略:下一篇⇢



















