——全固態鋰離子電池
廖譽凱/畢業於花蓮私立四維高級中學與國立高雄師範大學物理系,現於臺灣師範大學物理系研究所就讀。從小對數理有極大興趣,喜歡從實驗中探索。
胡淑芬/臺灣師範大學物理系特聘教授。研究興趣包括半導體製程技術,奈米元件,光催化水分解、太陽能等光電應用元件以及全固態可撓式鋰離子電池。
劉如熹/臺灣大學化學系特聘教授。研究專長主要為以材料化學核心技術為基礎,發展各種綠能相關材料,可用於光轉換為光、電與熱,並可分別應用於發光二極體、水分解與生醫熱療等。
數位時代來臨後,行動電話、筆記型電腦幾乎已成為現代人的必備設備,其中能使 3C 產品進入大眾普及的關鍵,不只在於晶片做得好,電池的進步更是必備條件。為了能讓 3C 產品使用時間延長,科學家不停思考要如何增加電池的電容量,使 3C 產品更輕薄,即是將電池體積縮小,讓手機與筆記型電腦越來越輕、越來越薄。但在人類享受科技進步同時,卻發生了難以置信的噩耗。
2016 年,南韓三星公司發行的 Samsung Galaxy Note 7 發生多起爆炸事件,造成全球使用者恐慌,三星公司承認爆炸的主要原因即是因為電池設計不佳。這不禁讓大眾思考,為何每天都會使用的電池會爆炸,這樣使用手機安全嗎?科學家希望能解決安全問題,但鋰離子電池總是還有安全方面的疑慮,於是科學家提出了「固態鋰離子電池」的想法。
電池是什麼?
電池的結構為正極、電解液與負極,圖一中橘色的電極為正極(陰極),紫色的電極為負極(陽極),其中電池定義陰陽極時以放電為準。電池在放電時,陽離子由負極(陽極)經由電解液往正極(陰極)移動,電子也由負極(陽極)經由外部電路往正極(陰極)移動。以電路來說,燈泡代表電阻,電池代表電容,如果電路中沒有電阻,就會造成短路。電池內部也有電阻稱為內電阻,電池內電阻的大小也會影響電池的效率。
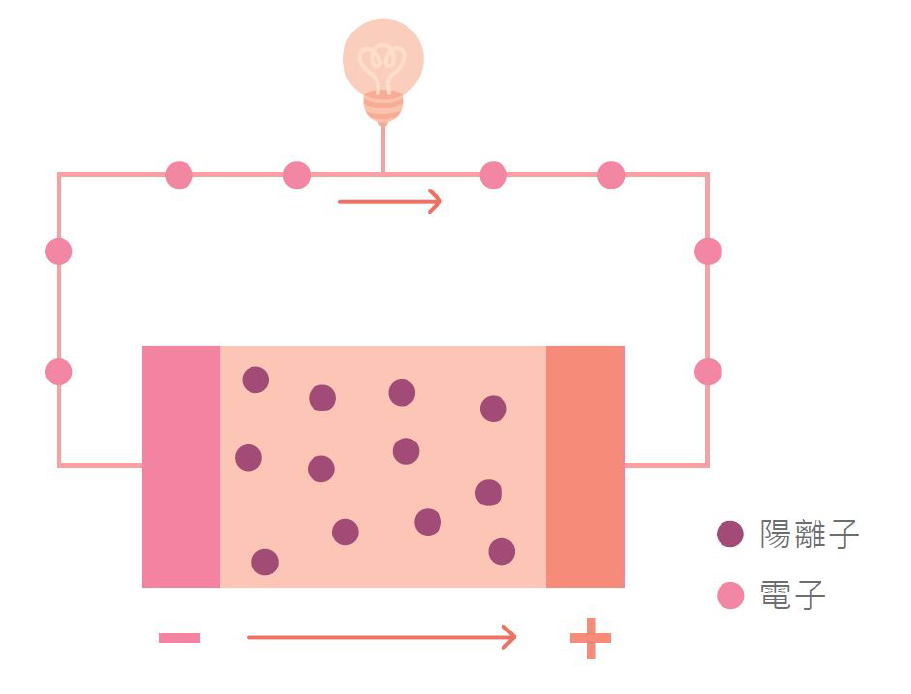
▲圖一:電池運作原理。
電池的起源最早可以追朔到 1780 年,由義大利的科學家伽伐尼(Luigi Aloisio Galvani)發現,他利用黃銅棒連接放置於鐵架上的蛙腿,使得蛙腿收縮,這為歷史上第一個具備電池組成要件的實驗紀錄:黃銅為正極(陰極),鐵棒為負極(陽極),蛙腿為電解質(液)。1800 年,義大利的伏打(Alessandro Volta)根據伽伐尼的實驗記錄,交錯排列銅片、鋅片與以鹽水浸濕的布料隔絕銅片與鋅片,成功做出第一顆電池。

▲圖二:伽伐尼與蛙腿實驗。圖片來源/Wikipedia,圖片提供/《科學月刊》
電池發展至今分為一次電池與二次電池,一次電池組裝完成時即為充滿電的狀態,其使用後不能充電而必須丟棄。直到大家耳熟能詳的碳鋅電池被發明出後,一次電池才被大量使用。相較於一次電池,二次電池可以重複充放電,並有良好的充電可逆性,二次電池有非常多的種類,而最常使用的二次電池為鉛酸電池與鋰離子電池。鉛酸電池多用於交通工具,因鉛酸電池操作溫度廣、廉價並具備高循環壽命,但缺點為鉛具有毒性。鋰離子電池則替二次電池帶來跨世代的進步,鋰離子電池擁有高能量與功率密度、極為優秀的循環壽命與操作溫度廣的優點。目前鋰離子電池主宰所有儲能市場,平常使用的智慧型手機、手提電腦等產品大多數利用鋰離子電池為儲能設備。

▲圖三:伏打所製作的電池模型。圖片來源/GuidoB,圖片提供/《科學月刊》
鋰離子電池是什麼?
鋰離子電池就是使用鋰離子金屬氧化物(LiCoO2 或 LiMnO2)等做為正極(陰極)材料,負極(陽極)則採用碳材料(如石墨),而電解液則為液態鋰鹽有機溶劑,其中有隔離膜隔開陰陽極,圖四為其示意圖。鋰離子電池屬二次電池,其可重複充放電。因電池定義陰陽極時以放電為準。故放電的時候,電子從負極(陽極)經由外部電路回歸至正極(陰極),鋰離子離開負極(陽極)經由液態電解液回到正極(陰極)。充電的時候則循相反之路徑,電子由充電器外接至負極(陽極)的碳材料,同時鋰離子離開正極(陰極)經電解液進入到負極(陽極)。
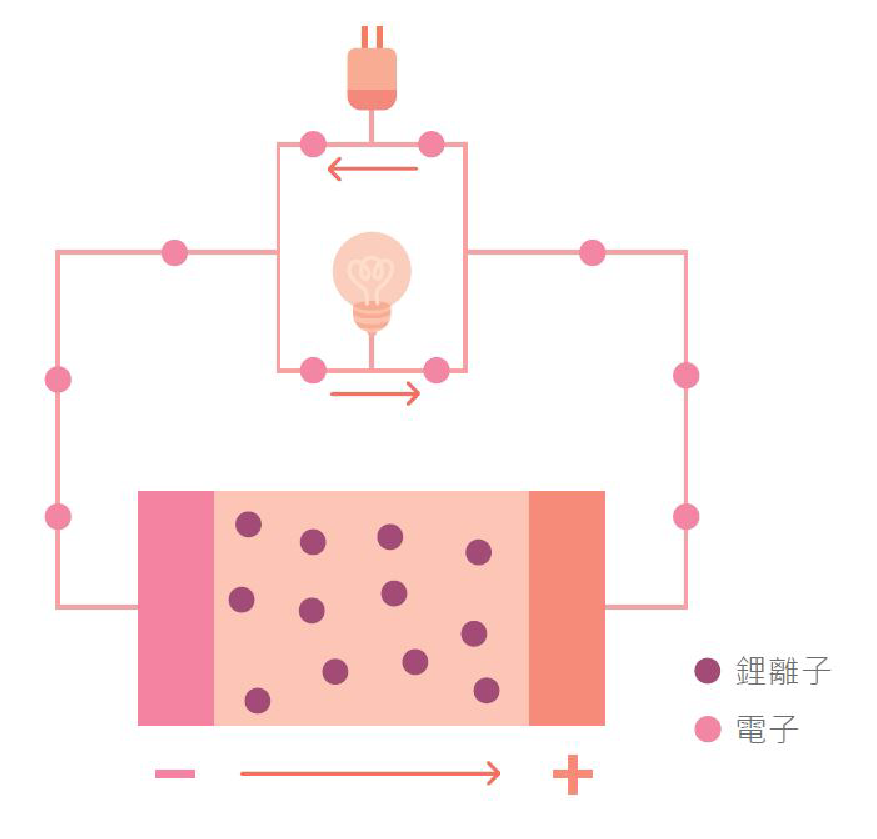
▲圖四:鋰離子電池運作原理。
1970 年,懷廷漢姆(Michael Stanley Whittingham)第一次發表鋰離子二次電池的概念,鋰離子電池正極使用二硫化鈦(Titanium(IV) Sulfide, TiS2)、負極使用鋰金屬製出第一顆可充電式鋰離子二次電池。但此種電池使用高危險材料,尤其二硫化鈦接觸大氣中的水氣會產生具毒性的硫化氫,而且鋰金屬在大氣中並不穩定,在正常的大氣環境下鋰金屬會燃燒,因此這設計並無法得到太大的關切,科學家轉而尋求穩定並可容納鋰離子的電極材料,提升應用的安全性。
1977 年,巴蘇(Samar Basu)發現鋰離子可嵌入石墨層間的現象,從此石墨成為可替代鋰金屬之安全負極材料。1979 年,古迪納夫(John Goodenough)展示使用鈷酸鋰(Lithium Cobalt Oxide, LiCoO2)與鋰金屬產出的鋰離子電池。數年後,其再度發表具橄欖石結構之磷酸鐵鋰(Lithium Iron Phosphate, LFP)作為正極(陰極)材料。此材料與鈷酸鋰相比,有更優秀的充放電壽命。
液態鋰離子電池
1991 年,第一顆商用型鋰離子電池由索尼(Sony)公司發表,其正負極分別由鈷酸鋰與石墨組成,而電解液則為液態鋰鹽有機溶劑。當時鋰離子電池能量密度小於每公斤 100 瓦小時(WhKg-1)。目前同樣大小之電池能量密度可達每公斤 200 瓦小時。鋰離子電池相比於傳統鉛酸電池,雖能量密度更高且更輕便,然而仍有下列幾項缺點:
(1)能量密度不夠高:
鋰離子電池已能廣泛運用於手機、照相機、行動電源等多項電子產品中,然而其能量密度仍遠不足以應用於電動車用電池中。
(2)成本高昂:
鋰離子電池陰極大多含有鈷金屬,價格相較於它種金屬來得高且變動大。
(3)液態電解質危險性:
電解液熱穩定性差,容易產生漏液汙染與易燃等問題,三星公司發表的 Samsung Galaxy Note 7 之所以會爆炸就是因為其造成正負極接觸短路爆炸,而液態電解質與隔離膜無法阻擋正負極接觸。
故科學家希望能夠解決液態鋰離子電池所遭遇的問題,最為重要的是安全性提升,因此提出了全固態式鋰離子電池的想法。
全固態式鋰離子電池
全固態鋰離子電池的組裝為正極、固態電解質與負極。其電解質因使用固態電解質(無隔離膜)所以沒有漏液汙染、易燃爆炸等問題,更因電解質為固態,電池不會因為隔離層破損就導致正負極接觸短路爆炸。且固態電解質能量密度高。與相同體積的液態鋰離子電池相比,可以有更高的充放電容量。其充放電原理與液態鋰離子電池相同(如圖四),放電的時候,電子從負極(陽極)經由外部電路回歸至正極(陰極),鋰離子離開負極(陽極)經由電解質回到正極(陰極)。充電的時候則循相反之路徑,電子由充電器外接至負極(陽極),同時鋰離子離開正極(陰極)經電解液進入到負極(陽極)。
固態電解質種類
固態電解質分為很多種,分別電解質的好壞最基本是由導電度決定,導電度的單位為每公分西門子(S/cm 或 Scm-1),西門子是電阻的倒數,等同於 Ω-1。其中高導電度的固態電解質大多為硫化物電解質,但硫化物電解質接觸濕氣後會產生具毒性的硫化氫(H2S)氣體,而且電化學穩定性較低,其於鋰離子固態電池的應用性較低。
於是科學家多半研究鈣鈦礦(perovskite)、鈉超離子導體(NASICON)與石榴石(garnet)型電解質,這三種電解質皆為氧化物電解質,氧化物電解質電化學穩定度高,且具有非常優秀的操作溫度範圍,最有可能成為未來發展固態鋰離子電池的趨勢。
現在商業化鋰離子電池大多使用液態電解質,但液態電解質有安全性的疑慮,而且能量密度與功率密度不高,高溫度時應用性低。固態電解質可有效解決上述問題,有更高的能量與功率密度,在高溫應用性相當高,更重要的是,固態鋰離子電池安全性高。固態電解質可同時做為電解質與正負極隔離層而且表現相當優秀,但至今仍未有固態鋰電池之產品上市,研究至今仍然有許多挑戰需要解決,固態電解質導電度不如液態電解質(導電度為 10-2 S/cm),而且固態電解質與正負極比起液態電解質,多了與正負極材料之界面阻抗,尚待未來進一步的改善。
延伸閱讀
1. 維基百科─電池、鋰離子電池、鋰鐵磷、金鈷氧、鈣鈦礦、NASICON、晶體結構。
2. 陳鐘誠,〈電池的歷史與原理〉,泛科學網站,2013 年 10 月 13 日。
⇠上一篇:改變軍事與能源的力量——核分裂與核融合
心臟微弱的生理訊號——利用心電圖辨識身分:下一篇⇢
本文轉載自《科學月刊》2017 年 5 月號