為什麼我們需要細胞治療?
林泰元∕臺灣大學醫學院藥理學研究所、台灣細胞醫療協會理事長。
黃彥華∕臺北醫學大學醫學院細胞治療與再生醫學博士學位學程、台灣細胞醫療協會常務理事。

在正式開始介紹細胞治療之前,我們先來看一位美國白血病患者懷特海德(Emily Whitehead)的故事:懷特海德於 5 歲生日時,被診斷出患有急性淋巴細胞白血病(acute lymphoblastic leukemia, ALL),在經過一系列化療後仍舊無法控制其病情。這種復發型的白血病讓懷特海德的生命危在旦夕,於是懷特海德的父母決定帶她到費城兒童醫院(the Cancer Center at Children’s Hospital of Philadelphia)尋求不同療法。在那裡,他們得知由賓州大學研究人員──瓊(Carl June)與其研究團隊開發的一種新療法,稱為嵌合抗原受體 T 細胞療法(chimeric antigen receptor T-cell therapy, CAR-T)──CART-19(藥物學名:tisagenlecleucel)。
CAR-T 是由藉由基因工程改造病人自身的 T 細胞,使其可以辨識帶有細胞表面蛋白質標誌 CD-19 的 B 細胞所衍生的腫瘤細胞並且殺死它們。當時年僅 7 歲的懷特海德,成為第一位參與 CART-19 細胞療法臨床試驗的患者,而現年 16 歲的她,白血病再也沒有復發過。2017 年 8 月 30 日,美國食品藥物管理局(U.S. Food and Drug Administration, FDA)正式批准由諾華藥廠(Novartis)負責生產 tisagenlecleucel,並以「Kymriah」為品牌進行銷售,用來治療 25 歲以下難以治療或復發型的急性淋巴細胞白血病患者。
取自於細胞的「細胞治療」
什麼是「細胞治療」?簡單來說,細胞治療就是從病患身上提取出需要的特定健康細胞,透過擴增培養與必要時的基因改造,再將它們輸回同一位患者體內(autologous,自體);或是使用來自特定細胞供應者(super donor)提供的細胞,一樣經過擴增培養,或必要時的基因改造以治療其他患者(allogeneic,同種異體)。目前「細胞治療」可以簡單分為「免疫細胞治療」與「幹細胞治療」,這類新興療法有機會治癒自體免疫疾病和癌症等難以治療的疾病,提供患者復原的希望。
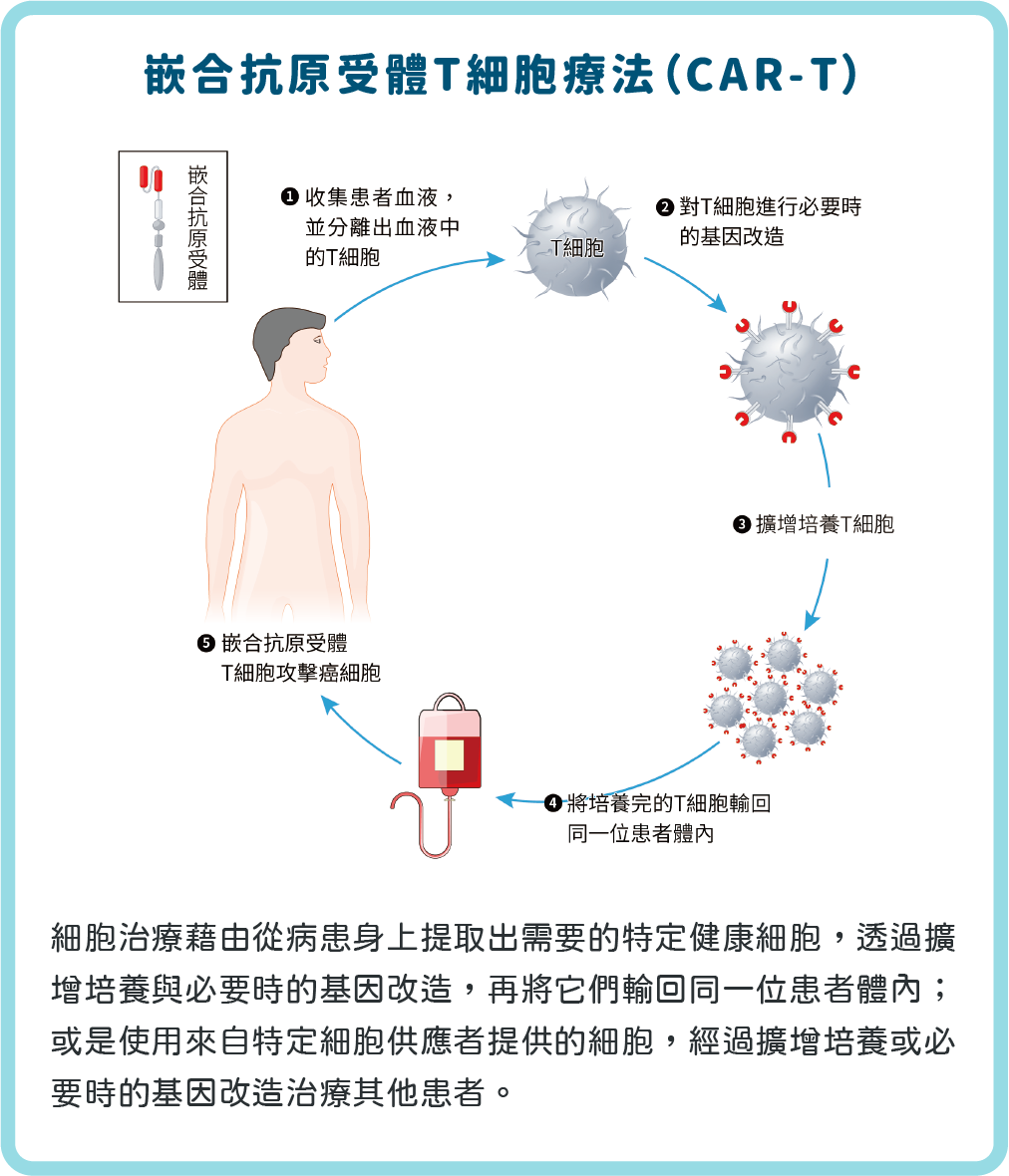
嚴格來說,細胞治療並不能算是一種新的治療方式。早在 1957 年,美國醫生湯瑪斯(Edward Thomas)就已完成了人類第一例的骨髓移殖(hematopoietic stem cell transplantation),而他也以「人體器官和細胞移植的研究」成果獲得 1990 年諾貝爾生理學醫學獎(Nobel Prize in Physiology or Medicine)。事實上,骨髓移植就是一種典型的細胞治療,此種療法也醫治了白血病、淋巴瘤、再生不良性貧血、骨髓造血不良症候群,以及多發性骨髓瘤等重大疾病,只是在當時「有細胞治療之實而無細胞治療之名」。時至今日,全世界已經有超過 100 萬例以上的骨髓移植案例。
1988 年,法國醫師葛魯克曼(Eliane Gluckman)也成功完成世界首例的臍帶血造血幹細胞(hematopoietic stem cells, HSCs)移植,用來治療先天再生不良性貧血的患者,從此臍帶血也成為細胞治療的選項,不再被視為廢棄物。隨著醫學進步,目前國際間的臍帶血應用範圍已經廣達 80 餘種疾病,更衍生出臍帶血保存的商業模式及細胞治療產品。
以史為鑑看細胞治療
讓我們再次回顧懷特海德的故事,試想在當時藥石罔效的時刻,病患與家屬面對這種罕見疾病也只能抱憾以對,接受患者可能不久後就會離開人世的事實。然而 CART-19 細胞療法適時出現,帶給病患與家屬一絲希望,也正是因為懷特海德的成功案例,使得科學家與臨床醫師,以更嚴謹的臨床試驗來驗證這種嶄新療法對病患的療效。而懷特海德的父母更因此成立「艾蜜莉.懷特海德基金會」(Emily Whitehead Foundation),為 CAR-T 細胞療法的研究籌集資金,讓此療法可以成為常規的治療選項。相較於癌症的標準化學治療或放射治療,對兒童帶來的副作用時間較長,且較為嚴重,CAR-T 細胞療法的毒性較小且更具針對性,因此對於治療兒童癌症有極大助益。
檢視歷史時,有時前後事件的發生總有著令人驚訝的相似性。美國的丹娜.法伯癌症研究所(Dana-Farber Cancer Institute)是世界頂尖的癌症醫院,在其研究所的一角矗立著創始人之一──美國兒童病理學家法伯(Sidney Farber)與他最早期患者之一,12 歲的「吉米」(Jimmy, Einar Gustafson)雕像,用來紀念那一段開創了現代化學療法先河的歷史。
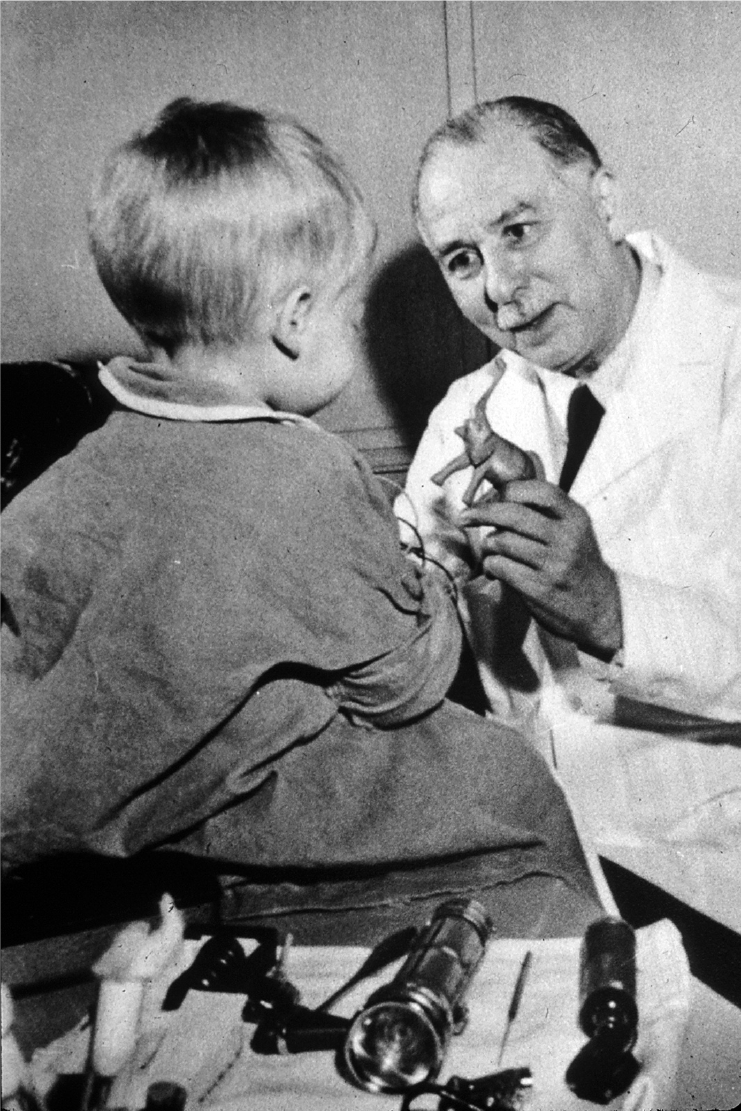
▲丹娜—法伯癌症研究所是世界頂尖的癌症醫院,圖右為創始人之一美國兒童病理學家法伯與他的患者。圖片提供/《科學月刊》,圖片來源/National Cancer Institute, Public Domain, Wikimedia Commons
在 1947~1949 年間,法伯在 16 名患者身上嘗試利用一種葉酸(folic acid)的拮抗劑──氨基蝶呤(aminopterin)來治療白血病。試驗結果顯示有 10 名患者的症狀得到了暫時性緩解,雖然這在當時是一項不得了的突破,但法伯的這項工作並未受到重視,許多研究者甚至不相信他的發現。之後,法伯又進行了一系列臨床前研究與臨床試驗,最終透過一系列論證,才證明他的發現正確,也正因為這項貢獻,法伯被視為現代化學療法之父,也因此在外科手術、放射治療之外開創了現今的化學療法。比對懷特海德使用 CAR-T 與法伯治療吉米的故事,相信細胞治療也將會依循過去的經驗而發展。
百家爭鳴的細胞治療
如今,世界上各個醫療先進國家無不積極投入開發細胞治療,這不僅攸關了人民醫療福祉同時也隱含著國安考量,其中「免疫細胞治療」以基因修飾的免疫細胞為發展重點,例如 CAR-T 與 CAR-NK(chimeric antigen receptor nature killer-cell,嵌合抗原受體—自然殺手細胞)等。目前 FDA 所核准的 22 項細胞與基因治療產品,除了 8 種臍帶血所衍生的細胞治療產品之外;尚有 6 種免疫細胞治療產品,包括 5 種 CAR-T 細胞治療產品,1 種樹突細胞(dendritic cell)治療產品;另外,有 4 種利用不同纖維母細胞(fibroblast)與基質(matrix)構成的細胞組織工程產品,用以修復各類表皮組織的損傷;除此之外,還有 3 款基因工程產品及 1 款溶瘤病毒(oncolytic virus)產品。而 FDA 所公告核准的細胞產品,也呈現出這類細胞產品的發展主要趨勢。
至於另一主軸「幹細胞治療」,以 FDA 所核准的 4 個細胞組織工程產品為例,其中 3 個產品(Gintuit、Laviv、Stratagraft)主要是利用不同纖維母細胞,與不同基質來構成修復組織所需要的產品;至於另外一個產品(Maci),則是使用病患自己的軟骨細胞(chondrocyte)與來自豬的膠原蛋白(collagen)製成的基質膜結合,製造出產品後用於修復膝關節軟骨缺損。
然而,對於已在許多國家進行臨床試驗的間質幹細胞(mesenchymal stem cell, MSC),FDA 至今仍未核准任何直接使用間質幹細胞產品,唯有日本核准「Temcell」這項間質幹細胞產品上市。它在日本主要用以治療造血幹細胞移植後的嚴重併發症「急性移植物對抗宿主反應」(graft-versus-host disease, GvHD),並於 2015 年 9 月獲得日本厚生勞動省的批准上市使用;另外尚有由日本大阪的製藥公司尼普洛(Nipro Corporation)與札幌醫科大學合作開發的自體骨髓間質幹細胞產品「Stemirac」,用來治療脊髓損傷,並於 2018 年獲批准在 7 年內有條件、有限制上市。
世界各國與臺灣的細胞治療法規進展
為了推動這類新興的細胞治療,過去的經驗告訴我們:不只需要有充裕的研發經費來支持研究工作,對於相關醫療行為更重要的是法規協助。美國最早制定《公共衛生服務法》(Public Health Service Act, PHSA)對人類細胞、組織,與細胞或組織物的操作進行規範。而為了協助加速醫療產品開發,並為需要它們的患者提供更快、更有效率的創新和進步,美國更在 2016 年 12 月 13 日完成《21 世紀醫療法案》(21st Century Cures Act)的立法,其中更規範「再生醫學先進療適用資格」(Regenerative Medicine Advanced Therapy Designation)的認定,與加速審核的規定以加強實現臨床試驗設計現代化的能力,並加速新型醫療產品的開發和審查。
至於歐盟(European Union, EU)則是將細胞治療、組織工程產品、基因治療規屬於新興醫療產品(advanced therapy medicinal product, ATMP)的範疇;而日本為推動再生醫療,於是修法由厚生勞動省的醫政局主責《再生醫療等安全性確保法》,依細胞治療的風險分級管理,分為自由診療(醫療技術)與臨床研究。此外,厚生勞動省中的醫藥品醫療機器總合機構(Pharmaceuticals and Medical Devices Agency, PMDA)更就再生醫學、新增細胞治療、基因治療等產品,修訂《藥品醫療機器法》(藥機法)要求這些產品須執行臨床試驗(IND)、查驗登記申請(NDA),並且創新建立「有條件核准」機制,在二期臨床試驗完成後確保安全、有效的情況下,可以先行有條件核准上市,但需在 7 年內完成療效確認性臨床試驗。
臺灣衛生福利部在 2018 年通過的《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》(以下簡稱《特管法》)修正條文中,也納入了非基因修飾的細胞治療。除了自體 CD34+ selection 周邊血幹細胞、自體脂肪幹細胞、自體纖維母細胞、自體骨髓間質幹細胞、自體軟骨細胞之外,也包含自體免疫細胞治療,例如:
.CIK(cytokine-induced killer cell):細胞激素誘導殺手細胞,是一群 T 細胞—自然殺手細胞的免疫細胞混合體
.NK(Nature killer cell):自然殺手細胞
.DC(Dendritic Cells):樹突細胞
.DC-CIK:由體外共同培養的樹突細胞及細胞激素誘導殺手細胞(CIK)進行的合併治療
.TIL(tumor-infiltrating lymphocytes):腫瘤內特有之浸潤性淋巴細胞
.γδ:γδT 細胞,一種不需藉由樹突細胞提供資訊,就能辨識與殺死多種癌細胞的 T 細胞
以上這些未經基因修飾的免疫細胞療法。雖然在不同的醫學期刊上都曾經報導過這類細胞治療的療效,但由於目前尚未有大規模、雙盲、隨機、對照試驗驗證,因此與其說它們是細胞治療產品,不如以「治療手段」或「醫療方法」形容更為貼切,也期待臺灣能在《特管法》之外,盡快針對細胞治療與再生醫學訂定專法,幫助細胞治療發展。
細胞治療的挑戰與希望
當法伯用化療藥物治療吉米的時候,他絕對沒有料到在 60 餘年後,細胞治療居然也依循了過去的經驗發展,用來治療兒童白血病。再細看懷特海德所使用的 CAR-T,比起氨基蝶呤這種小分子藥物,CAR-T 顯得更加複雜與難以操控,顯然依循化學療法所建立的傳統評估模式,不足以套用在目前的新型細胞治療上。僅管現今的科技能透過流式細胞儀(flow cytometry)、次世代定序分析(next generation sequencing, NGS)等先進技術,精準的分析製備出的細胞藥物種類、比例、基因表現,甚至於分泌的各種大、小分子等,但細胞是活的,一但輸入人體後就會增殖、分化,同時分泌各種蛋白質與分子等,使得細胞在體內的分布、代謝、藥物動力學(pharmacodynamics, pharmacokinetics)都與傳統小分子藥物截然不同。
不論是小分子藥物、抗體藥物、細胞藥物,對於病人安全與療效評估的要求是永遠不變的真理。如何尋找新的方法來評估細胞藥物的藥物動力學及藥毒理學,將是細胞治療的最大挑戰,而細胞治療所發揮的療效,僅管目前我們只知其然而不知其所以然,卻也是鼓勵所有從事細胞治療研究工作者與臨床醫生最大的希望!
⇠上一篇:從退化性關節炎看《特管法》的個案審查
科幻中的未來醫學:下一篇⇢
本文轉載、修改自《科學月刊》2021 年 9 月