陳淵銓∕仁德醫護管理專科學校助理教授。

細胞治療是可用於診斷、治療,或預防疾病的新興醫療方法,其類型及機轉與傳統藥物明顯不同,因此開創了嶄新的醫療領域,並提供病患另類的治療選擇,更為難以治療的疾病帶來了痊癒的一線曙光。
細胞治療起初主要用於抑制器官或骨髓移植時引起的排斥反應(rejection),但近來已往適用於治療心血管疾病、神經退化性疾病、代謝性疾病、癌症、再生醫學等領域發展。雖然大多仍處於實驗室研究或臨床試驗階段,但部分已獲相當成果,例如有些適用於治療心血管疾病、癌症、再生醫學的產品已被核准上市(表一),且在國外被列為「先進醫療產品」(advanced therapy medicinal product, ATMP)。
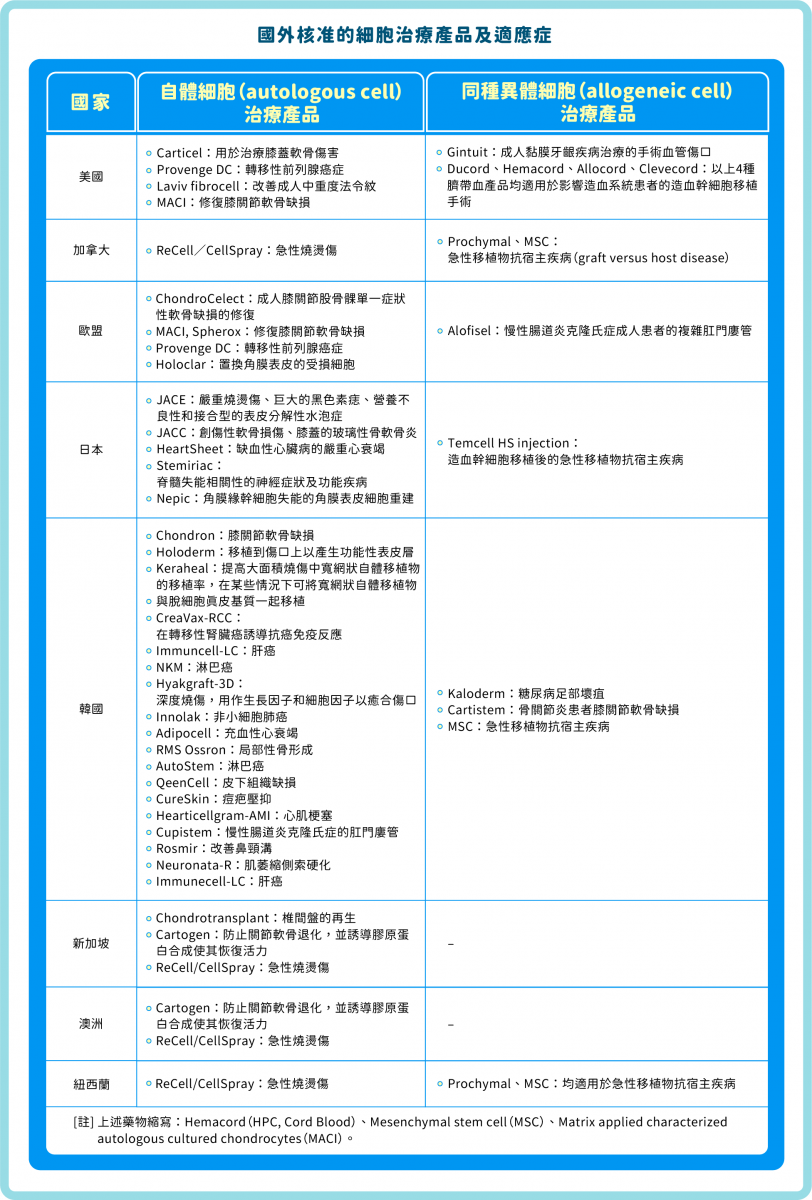
▲表一
由於生物技術發展迅速,細胞培養、加工、保存等技術逐漸成熟,使得細胞治療前景被看好。在國外已有很多生技公司和藥廠投入更新型產品的研發和生產,以尋求疾病治療的突破,改善患者的生活品質。
細胞治療的進展
免疫細胞對抗癌症
1. 免疫細胞得擴增及回輸
透過培養及擴增自體T細胞及自然殺手(natural killer, NK)細胞,再回輸入癌症病人體內,作為化學治療之外的輔助療法。目前,此方式大約有 20~30% 的病人可看到效果,但即使癌症病友的病情有部分改善,也無法完全治癒。此外,也有擴增單核球(monocyte)分化而生成的樹突細胞(dendritic cell)來治療前列腺癌的方法,但這種單純的自體免疫細胞擴增療法,成效仍十分有限。
2. T細胞基因改造的CAR-T細胞
近年以免疫細胞治療癌症之所以能夠聲名大噪,主因是 2011 年新發展出來改造病人 T 細胞基因的嵌合抗原受體 T 細胞(chimeric antigen receptor-T cell, CAR-T)療法,並非來自於自體免疫細胞擴增治療。現已證明 CAR-T 療法在 B 淋巴球所衍生出來的癌症,例如急性淋巴性白血病及慢性淋巴性白血病等都有顯著的治療效果,最近更已發展到瀰漫性 B 細胞淋巴瘤的治療,也有相當成效。例如美國食品藥物管理局(U.S. Food and Drug Administration, FDA)在 2017 年已核准兩種使用 CAR-T 療法的細胞治療產品,主要是用於治療 25 歲以下的復發性和難治性 B 細胞急性淋巴性白血病(acute lymphoblastic leukemia) 患者的 Kymriah(tisagenlecleucel),以及特定型大 B 細胞淋巴瘤(large B-Cell lymphoma)成人患者的 Yescarta(axicabtagene ciloleucel)。
幹細胞的再生治療
在幹細胞的再生醫學研究方面,真正用於臨床治療的產品是間質幹細胞(mesenchymal stem cell, MSC),而誘導性多功能幹細胞(induced pluripotent stem cells, iPSCs) 則仍在臨床試驗階段。目前可於異體使用的 MSC 產品都是用來治療免疫疾病為主,並非真正的再生醫學註,例如以自體 MSC 加上組織工程的細胞治療產品,在用於治療全身性類風濕性關節炎可見成效。目前臺灣也有醫學中心及廠商,開發 MSC 治療技術或進行臨床試驗。
細胞治療的期待、限制、挑戰
免疫細胞對抗癌症
單純的免疫細胞擴增回輸療法,對於癌症病人的治療效果仍有限,反應率只有 20~30%,無法顯著延長病人的生存期。目前最熱門的免疫抗癌方法是 CAR-T 細胞及免疫檢查點抑制劑(immune-checkpoint inhibitor)治療。
在 CAR-T 細胞治療方面,已知嵌合抗原受體(chimeric antigen receptor, CAR)由來自單株抗體(monoclonal antibody) 的單鏈變異區域(single-chain variable domain)、膜間區域(transmembrane domain)及 T 細胞的訊息傳遞區域(signal transduction domain, CD3)組成。例如自病患體內分離取出 T 細胞後,在活體外將其製造成 CAR-T 細胞,為改善其對肺癌細胞的結合能力(binding capacity),可使用基因編輯技術 CRISPR 改造 CAR 的結構,使其回輸原病患體內後,能夠專一性的辨認並殺死肺癌細胞,而不致傷害到正常的細胞(圖一)。目前期望發展出更多的治療適應症,尤其是關於實體癌症的治療。
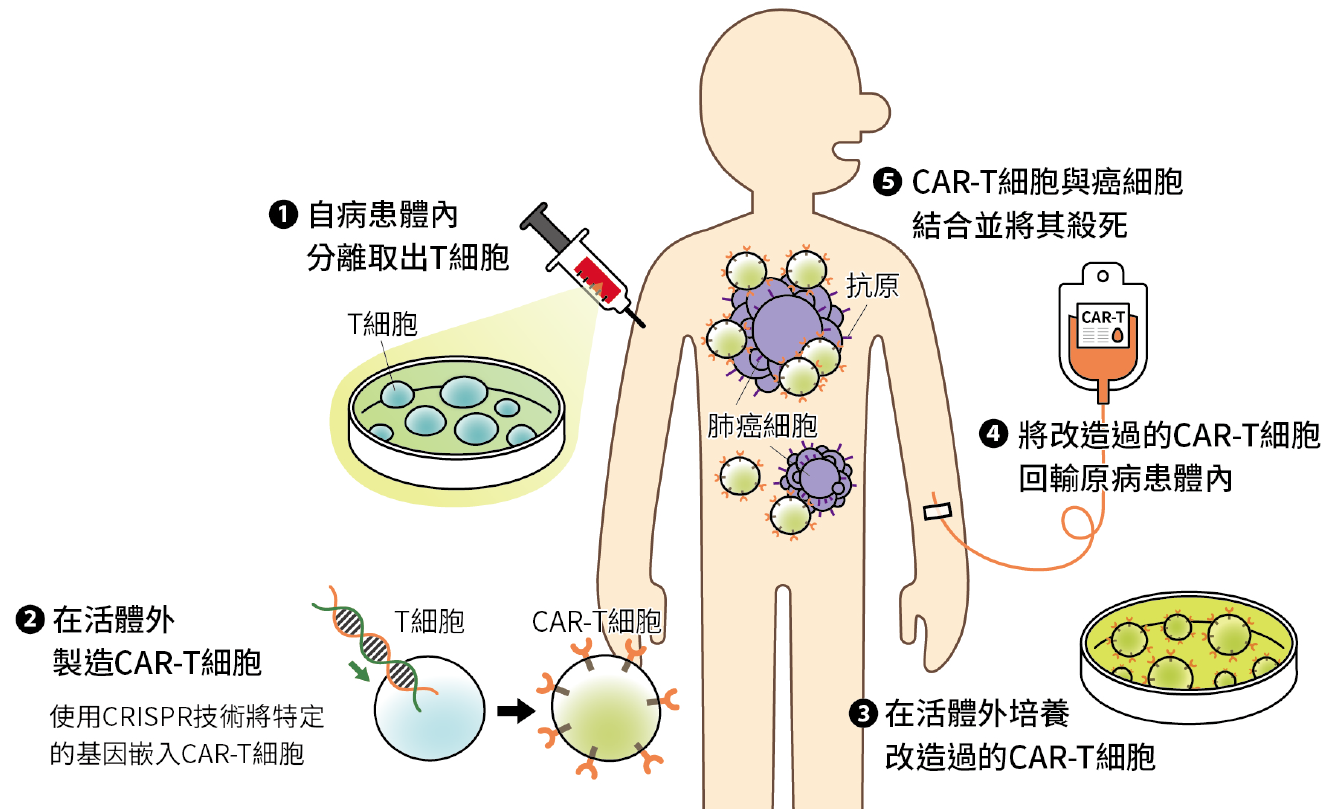
▲圖一
在免疫檢查點抑制劑治療方面,已知免疫檢查點是一種體內的免疫調節機制,正常人藉由調控配體(ligand)及受體(receptor)的作用而使 T 細胞的作用處於平衡狀態,當 T 細胞被活化時會表現較多的免疫檢查點受體,例如 PD-1(programmed cell death protein 1)等。當這些受體與抑制性的配體結合時,T 細胞的活性會受到抑制,以避免產生過強的免疫反應而傷害正常細胞。癌細胞因發生突變而具有新抗原(neoantigen),理論上這些新抗原應可被免疫系統辨認出來而活化 T 細胞增生以消滅癌細胞,但是癌細胞卻能繼續存活且增殖,意味著癌細胞可躲過免疫系統的監視。
最近的研究顯示,癌細胞可以利用免疫檢查點的機制來減弱 T 細胞的活性。使用新型單株抗體(monoclonal antibody)作為免疫檢查點抑制劑,可以強化免疫細胞的抗癌效率,現已知這些單株抗體在一些病例有不錯的抗癌效果,甚至少數病人可以痊癒。例如肺癌細胞可以表現較多的 PD-L1 配體(programmed cell death protein ligand 1),藉由和 PD-1 受體結合以抑制 T 細胞的免疫作用,目前美國食品藥物管理局已正式核准單株抗體,例如抑制 PD-1 受體的 Nivolumab 和 Pembrolizumab;抑制 PD-L1 配體的 Atezolizumab 和 Durvalumab,用於肺癌的免疫療法(圖二)。在少數個案的臨床試驗中,利用化學治療加上免疫檢查點抑制劑的合併療法,已被接受為癌症治療的第一線處方,例如胰臟癌的免疫療法。
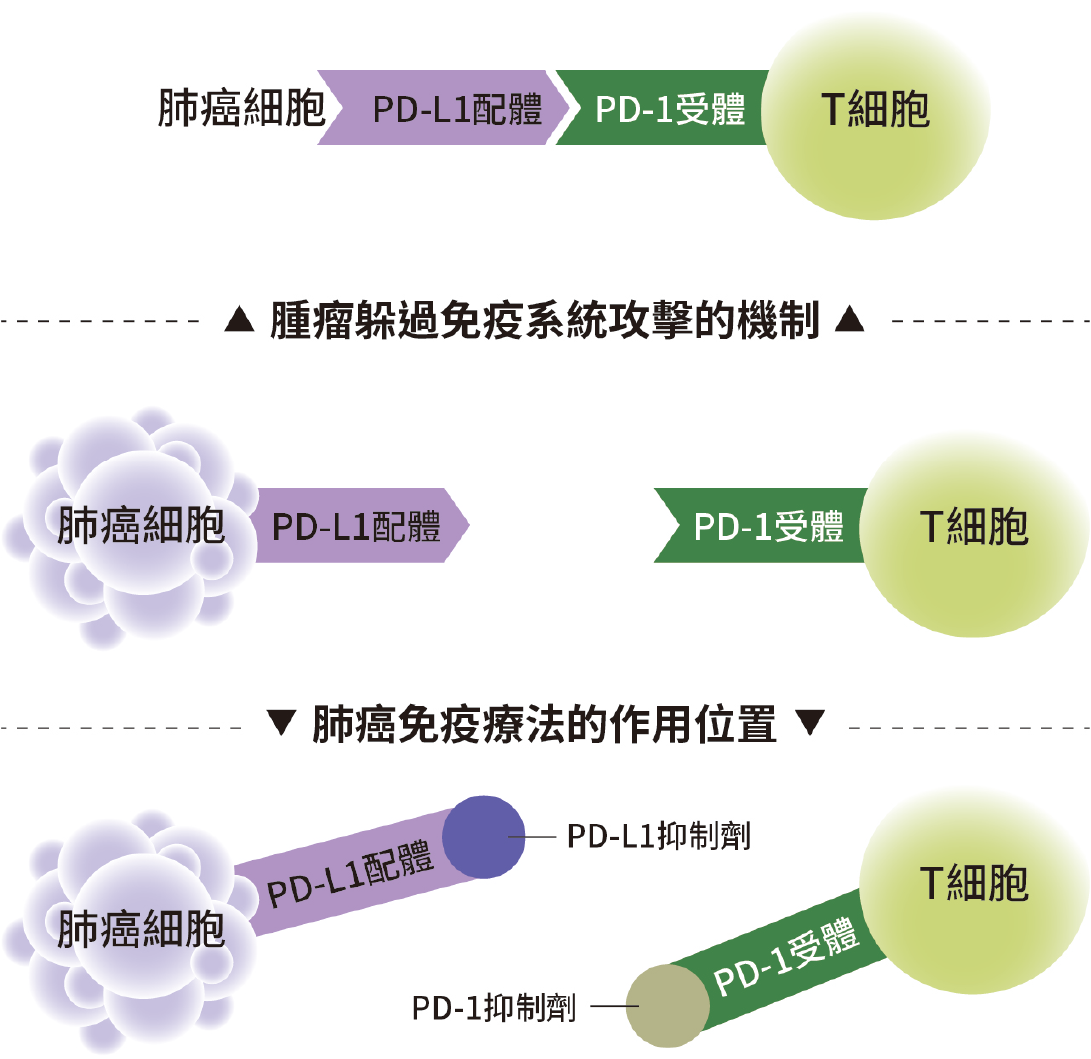
▲圖二
幹細胞再生醫學
在 MSC 用於再生醫學方面,因為人體的器官、組織及細胞的結構、大小、數量、功能、常用的實驗動物仍有不少差異,所以異體 MSC 的臨床試驗結果與動物實驗結果差距甚大,尚待改善製程或處方以提升治療效果,國外也在持續進行相關研究及試驗。至於 iPSCs 看似潛力無窮,臨床試驗目前也仍正在國外進行中,但仍有主要限制如下:尚無大型臨床試驗結果,使用異體 iPSCs 引起的排斥程度尚不明確,未能完全排除引起細胞突變及癌化的疑慮及費用昂貴等。
目前的細胞治療大多是使用自體細胞,將病人本身的細胞取出在體外經加工改造及培養後,再回輸病人體內,如此便不會引起排斥反應最為安全,但是使用自體細胞並無法量產以降低成本,造成治療費用非常高昂。目前 iPSCs 被認為最有潛力成為同種異體細胞療法的材料,這種細胞若能在適當的環境條件下培養,可近乎無限制地進行細胞分裂,讓許多研究人員及廠商思索利用基因編輯技術去除 iPSCs 上的人類白血球抗原(Human leukocyte antigen, HLA),而 HLA 被認為是引發排斥反應的主因。
由於去除 HLA 後的 iPSCs 仍可無限制分裂,可作為細胞種源庫供大多數人使用,能大幅降低治療成本,但去除 HLA 需要複雜的操作及長期的監控來證明安全性,故現在仍處於研究階段。2012 年諾貝爾生理及醫學獎(Nobel Prize in Physiology or Medicine)得主──iPSCs 發明者山中伸彌於日本京都大學,建置了不同 HLA 同型合子的 iPSC 細胞庫,可根據病人的 HLA 挑選適合的 iPSCs,搭配使用抗排斥藥物,即可抑制移植物對抗宿主疾病(Graft versus host disease, GVHD),甚至可能在特定狀態下不服用抗排斥藥物也不會引發 GVHD,使成本較為低的同種異體細胞治療相當具有可行性。
細胞治療在國外發展相當迅速,先進國家對這種特殊產品的相關法規通常有暫時性或條件性的規定,審查機制則較具彈性(flexibility)或有快審制度(fast track)。儘管細胞治療產品在國外已成功上市,但綜觀先進國家發展的經驗,仍可發現它們在技術或倫理上曾遭遇或正在面臨一些挑戰(表二)。

▲表二
細胞治療在臺灣的發展現況及未來
臺灣衛生福利部於 2018 年 9 月公布《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》(以下簡稱《特管法》)修正案之後,開放自體免疫細胞、自體脂肪幹細胞、自體骨髓間質幹細胞、自體纖維母細胞、自體軟骨細胞共 6 類細胞治療技術,可於國內核准的醫療機構施行。因此,合法的細胞治療只有 3 類,包含臨床試驗、《特管法》核可的 6 大類自體細胞治療技術、恩慈療法(compassionate use)。為避免病患接受這類新型療法時受到傷害,並保障治療的有效性及安全性,這 3 類治療都必須經過衛生機關審核才能執行,並非任何醫療機構都能夠進行。目前臺灣《特管法》規定的 6 類細胞治療技術雖然均僅適用於自體細胞,尚未核准用於幹細胞再生醫學,但是用於大規模、大面積的燒燙傷患者同體異體細胞的恩慈治療仍是可行的方式,例如新北市八仙塵暴的燒燙傷患者。
大部分的疾病常規治療,都是已經過試驗證實的有效治療方法,隨著醫療技術的進步與新型藥物的出現,很多以往認為是藥石罔效的疾病,現在都有很好的療法。因此,病患應先考慮常規治療,若常規治療無法控制疾病,才考慮使用細胞治療。若病人直接進行細胞治療,而放棄常規醫療,恐無法達到治療的效果,甚至可能導致疾病惡化到不可收拾的地步。依目前的臨床證據及試驗結果顯示,大部分的細胞治療仍在累積更多經驗階段,仍需更多的臨床數據證明有效、安全及製程、療法的改進,屬於中高風險的醫療行為。因此,細胞治療並非疾病治療的萬靈丹,接受治療前應徵詢專業醫師的意見,衛生主管機關均會以高規格的方式來監督細胞治療進行,以確保病人的權益。
註:利用幹細胞的分化及增生特性,修補器官或組織的損傷。
⇠上一篇:從愛因斯坦方程式到超級電腦黑洞模擬——數値相對論發展歷史
從退化性關節炎看《特管法》的個案審查:下一篇⇢
本文轉載、修改自《科學月刊》2021 年 9 月





















