碳的同素異形體點點名
顏宏儒/中研院化學所助研究員,致力於奈米石墨烯和儲能材料相關研究。

「石墨(graphite)」一詞聽起來或許有些陌生,但只要撥開日常生活中常見的碳鋅電池,就可以看到裡頭的黑色石墨棒;再生活化一點來說,鉛筆的筆芯也是經由石墨和黏土混合而製成。而更令人難以相信的是,又黑又軟的鉛筆筆芯和堅硬又漂亮的鑽石,兩者都是由碳原子組成,但為什麼性質會差那麼多呢?
不一樣,都一樣?其實我們是同素異形體啦!
石墨與鑽石其實是「同素異形體(allotropy)」,而同素異形體是指由同一種化學元素所組成,但其結構、物理性質、化學性質或形態不相同的單質。碳原子最常見的同素異形體為鑽石和石墨,雖然兩者都是由碳原子建構而成的,但它們卻顯現完全不同的性質,這是由於它們的原子以不同的方式連結在一起。除了石墨與鑽石之外,碳原子還有許多不同的同素異形體,本文將介紹碳原子如何架構成不同形式的單質,以及這些單質的原子結構及特性,這些單質包括石墨、鑽石、富勒烯、奈米碳管與石墨烯(圖一)。
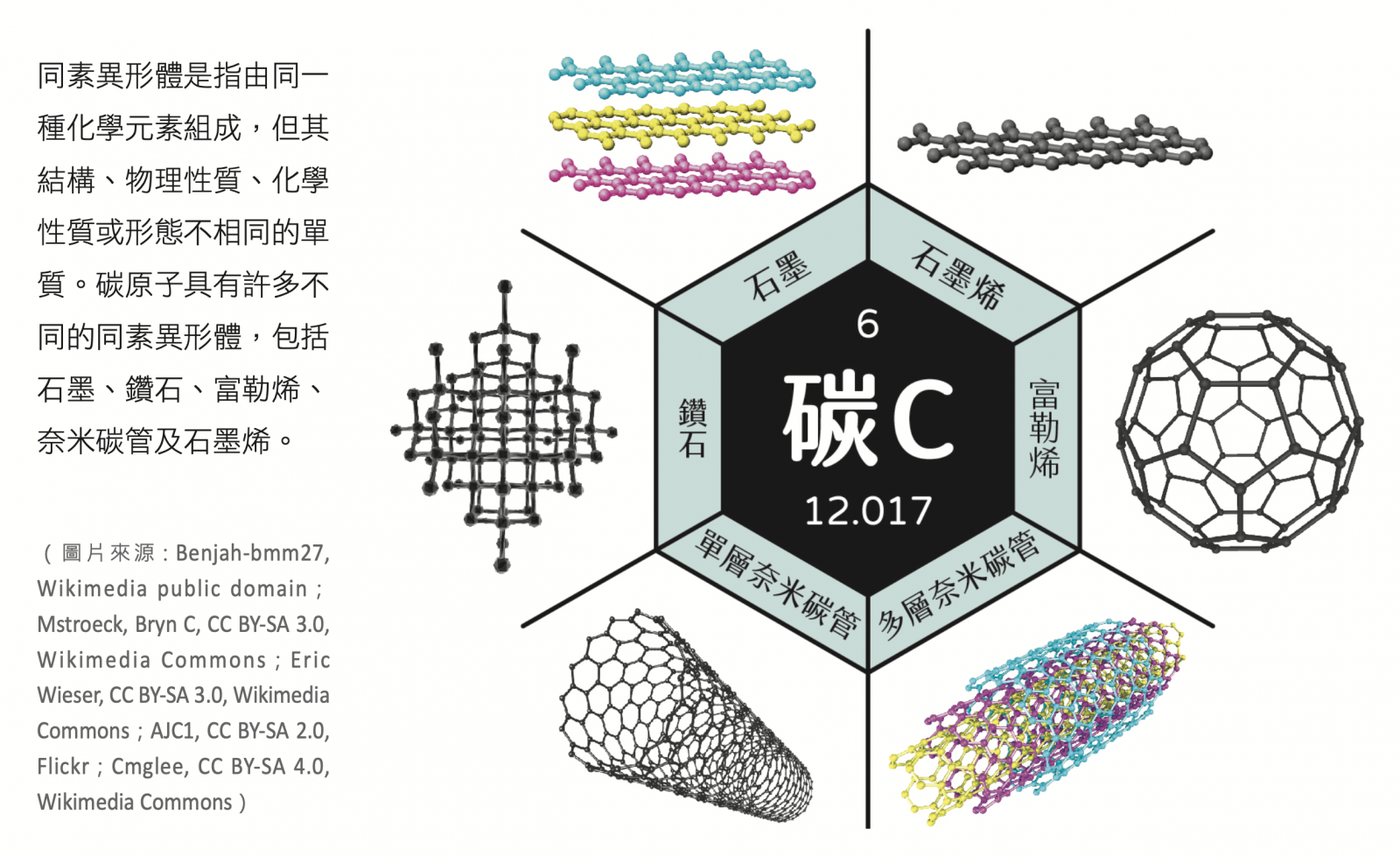
▲圖一:有許多同素異形體的碳原子
鉛筆真的不含「鉛」 石墨才是本體
石墨又稱黑鉛(black lead),具有耐腐蝕性。石墨這個詞由 18 世紀的德國地質學家維爾納(Abraham Gottlob Werner)所命名,其希臘文的意思是「書寫」。在 16 世紀英國人發現大量純石墨礦藏後,石墨立刻成為鵝絨筆及墨水之外的簡便替代品──也就是後來的鉛筆。
在石墨中,碳原子皆以層狀排列,每個碳原子與周圍的3個碳原子經由共價鍵連結,形成六角形的層狀結構,而層與層之間有微弱的凡得瓦力(Van der Waals force)。在石墨的層狀結構中,每層碳原子都排成蜂窩狀晶體結構,層內原子的間距為 0.142 奈米(nm),層間距 0.335 奈米。
這種層與層間較弱的吸引力,不僅使石墨成為最軟的礦物之一,也讓它的每一層原子可以輕易地在另一層原子上滑動。而石墨的原子層之間易滑動的特點,讓石墨可做為鉛筆筆芯和潤滑劑使用。此外,原子層之間弱的吸引力也讓少數電子可沿著層面流動,使石墨成為良好的導電體。
一顆永流傳,自然界硬度最大的鑽石
鑽石(diamond)是由碳原子組成的無色晶體,也是地球上已知最堅硬的物質。鑽石中的每一個碳原子,都與附近的 4 個碳原子以化學鍵互相連接,鄰近原子間的距離為 0.154 奈米,相鄰的鍵所構成的夾角為 109.5 度(圖二)。

▲圖二:鑽石中的每一個碳原子,都與附近的 4 個碳原子以化學鍵互相連接,組成了堅固嚴密的四面體結構,其分子結構質地十分堅硬,莫氏硬度高達 10。圖片來源/123RF,圖片提供/顏宏儒
在鑽石中,碳原子組成了堅固嚴密的四面體結構,這個看起來巨大的分子結構質地十分堅硬,莫氏硬度註高達 10,為自然界中硬度最大的物質,堪稱「硬度之王」。
像顆足球的超小型膠囊──富勒烯
長久以來,科學家一直以為碳原子只有石墨與鑽石兩個同素異形體。直到 1985 年,化學家柯爾(Robert Curl)、克羅托(Harold Kroto)和斯莫利(Richard Smalley)於實驗中無意地發現:石墨經高能量雷射撞擊後可形成氣體,再將氣體昇華後能得到碳族中較穩定的二種物質,若將其置於質譜儀上,實驗結果令人驚訝:這是二種物質重量分別為 60 個與 70 個碳原子連接起來的大分子,因此將它們定名為「碳 60(C60)」與「碳 70(C70)」,而這二種物質在他們的實驗中反覆出現,也引起他們好奇。
經過仔細分析後,他們發現碳 60 是由 12 個五邊形和 20 個六邊形交錯構成的封閉中空球體,而每一個五邊形旁都有 5 個六邊形緊接著,結構相當穩定。這樣的結構正是美國建築家富勒(Richard Buckminster Fuller)於 1940 年代創始的泡型圓頂建築的縮影,該建築於 1954 年獲美國專利,因此他們就把碳 60 命名為巴克明斯特富勒烯(Buckminsterfullerene),簡稱為富勒烯(fullerene);也由於它看起來像顆足球,又被稱作巴克球(buckyball),這也是目前已知對稱性最高的球狀分子。
後續科學家們的研究更發現:碳 60 並不會被人類的胃酸腐蝕,也不會被免疫系統當作入侵體內的異物,再加上它比一般生物體的細胞來得小,容易穿透細胞膜,可被製成各式抗體藥物,也能使愛滋病毒的酵素失去複製能力,因此被用來對抗愛滋病毒;此外,它中空的構造更可以攜帶藥物,做為「超小型膠囊」使用。柯爾、克羅托與斯莫利也因此於 1996 年獲得諾貝爾化學獎。
奈米碳管──太空電梯的好纜繩?
當科學家紛紛投入巴克球的研究時,日本筑波 NEC 實驗室的物理學家飯島澄男(Sumio Iijima)在 1991 年製作巴克球時,觀察到碳原子會排列成中空管狀,因而發現了碳的第 4 種 同素異形體:奈米碳管(carbon nanotube)。
奈米碳管可視為由石墨層捲曲起來的中空構造,平均半徑為 1.2 奈米,直徑在幾奈米~幾十奈米之間,長度可達數微米(μm),根據管壁層數的不同,可分為單壁(single-wall)奈米碳管和多壁(multi-wall)奈米碳管。前者僅由一層碳原子繞合形成管柱,結構對稱性極高,且缺陷較少;後者則是由多層碳原子捲起而形成的同軸碳管,橫切面就像樹的年輪一般,各層間距為 0.34 奈米,層與層之間以凡得瓦力互相吸引,結構中缺陷較多。
奈米碳管是目前人工能合成出的最細管子,它的強度是鋼的 100 倍,但重量僅有鋼的六分之一,其比強度(強度/密度)也較鋼高出兩個數量級,是質輕且機械強度高的物質。它也具有良好的導熱性質、低的密度(1.3~1.4 g/cm3)、好的彈性,受力後會彎曲,但外力除去後又可以恢復原來的形狀、高韌性,即使受到很大的力也不會斷裂、極其穩定。
在真空中,奈米碳管的抗熱分解溫度可高達 2,800℃,同時他也具備很好的抗蝕性與導電性。隨著奈米碳管的結構不同,它能具有金屬的導電性與半導體的特性,在極小電壓下可從尖端放出電子,具有絕佳的場發射效應(field emission, FE),因此可用於平面顯示器上。
而最令科學家們雀躍的是,因為奈米碳管具有十分優良的力學性能,這種「超級纖維」材料,極有可能做為通往月球電梯的纜繩,未來可能可以搭電梯上太空(圖三),不過現今還有很多技術上的問題還需要克服。
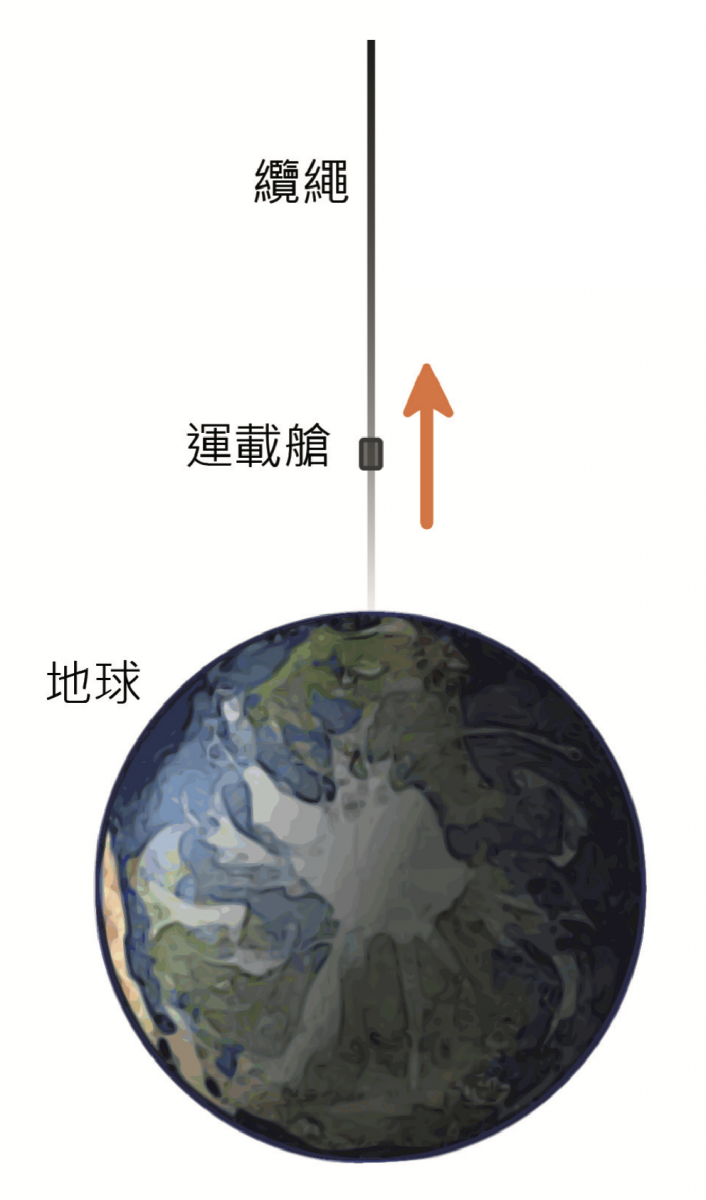
▲圖三:由於奈米碳管具有十分優良的力學性能,這種超級纖維材料,被認為極有可能做為通往月球電梯的纜繩,未來或許可以搭電梯上太空!圖片來源/Booyabazooka, CC BY-SA 3.0, Wikimedia Commons,圖片提供/《科學月刊》
薄又堅硬還能導電!夢幻奈米材料石墨烯
在石墨中,各個碳原子間以化學鍵連結形成六角形的層狀結構,這些原子層稱為石墨烯(graphene)。石墨烯一詞由德國科學家波姆(Hanns-Peter Boehm)創於 1962 年,是石墨(graphite)跟烯(-ene)字尾的結合,用以描述「單原子層的石墨」。
石墨烯長久以來被認為是一種假設性的結構,是只有一個碳原子厚度且無法單獨穩定存在的二維材料。直至 2004 年,英國曼徹斯特大學物理學家海姆(Andre Geim)和諾沃肖洛夫(Kostantin Novoselov)成功地從石墨中分離出石墨烯,而證實它可以單獨存在,兩人也因「在二維石墨烯材料的開創性實驗」為由,共同獲得 2010 年諾貝爾物理學獎。
石墨烯目前是世上最薄卻也最堅硬的奈米材料,它幾乎完全透明,只吸收 2.3% 的光;導熱係數高達 5,300 W/m‧K,高於奈米碳管和金剛石;常溫下其電子遷移率 (electron mobility)超過 15,000 cm2/V‧s,又比奈米碳管或矽晶體高;電阻率只有約 10-6Ω‧cm,比銅或銀更低,為目前電阻率最小的材料。由於它的電阻率極低,電子的移動速度極快,因此被期待可用來發展出更薄、導電速度更快的新一代電子元件、電晶體、透明觸控螢幕、光板,甚至是太陽能電池。
潛力無窮,碳原子的新紀元
碳的同素異形體研究成果接下來會如何發展,仍是一個無法回答的問題。但毫無疑問的是,大多創新的研究通常高度依賴超純且易懂的新材料,從矽到聚合物和高度精煉的金屬等都是如此。
知名物理學家費曼(Richard Feynman),在 1959 年於美國加州理工學院(California Institute of Technology)舉行美國物理學會上發表的演說「寬廣的底層(There's Plenty of Room at the Bottom)」中,提到操縱與控制微小物體是有可能的,當物體被縮小後,在微小世界仍有許多的空間。他對奈米技術和材料可能性的看法,已被證明具有高度先見之明,或許未來比鋼鐵強 20 倍的奈米技術能夠成功,奈米碳管或石墨烯在新的製備技術下能變得可延展,相信太空電梯或許在未來也有可能會實現!
註:莫氏硬度由德國礦物學家摩斯(Friedrich Mohs)提出,利用礦物相互刻劃,較軟的礦物會被較硬的礦物劃傷的標準,將地球上常見的礦物區分出 1~10 的不同等級,是一種相對標準,並非絕對硬度。
延伸閱讀
Richard Hollingham, Space elevators: Going up?, BBC Future, 18 Nov 2014.
塗料科學裡的堅韌因子:下一篇⇢
本文轉載、修改自《科學月刊》2021 年 2 月