帶領全世界對抗COVID-19
李依庭/《科學月刊》副總編輯。

2022 年唐獎「生技醫藥獎」得獎者



嚴重特殊傳染性肺炎(COVID-19)自 2019 年底於中國武漢爆發,至今已造成全球超過五億人口確診,導致數百萬人死亡。這場疫情不僅使我們的生命遭受威脅,更重創全球經濟。不過,比起兩年前面對未知病毒的恐懼,擔心染疫造成的重症,現在我們的體內不再是手無寸鐵對抗病毒,而是多了一份對抗病毒的武器⸺新冠疫苗。
2020 年 11 月,正當全球仍持續壟罩在疫情陰影之中時,美國輝瑞公司(Pfizer)/BioNTech 公司(BNT)、莫德納生物技術公司(Moderna)相繼宣布新冠病毒 mRNA 疫苗的研究成果。2020 年底,美國食品藥物管理局(U.S. Food and Drug Administration, FDA)更是陸續緊急授權輝瑞/BNT 疫苗(Pfizer–BioNTech COVID-19 vaccine)和莫德納疫苗(Moderna COVID-19 vaccine)的使用。兩款疫苗的成功與量產猶如一場及時雨,舒緩全球各地崩盤的醫療量能,並防止全球疫情跨大、造成更多人死亡。
兩家公司僅用不到 12 個月的時間,就完成 COVID-19 mRNA 疫苗的開發,而幕後的關鍵推手就是卡里科(Katalin Karikó)、魏斯曼(Drew Weissman)、庫利斯(Pieter Cullis)三位科學家。卡里科及魏斯曼找出能降低 mRNA 免疫原性的方法,庫利斯則開發了脂質奈米顆粒(lipid nanoparticle, LNP),用以傳送 mRNA 疫苗。2022 年 6 月,三位也因為發現關鍵的 mRNA 疫苗學觀念和方法,進而成功開發對抗 COVID-19 的 mRNA 疫苗,共同獲得第五屆唐獎生技醫藥獎的殊榮。
mRNA 疫苗為什麼難以研發?
現在我們已經知道 mRNA 疫苗的設計原理是將人工設計、可轉譯出病毒蛋白質片段的 mRNA 包裹在脂質奈米顆粒並送入人體中,脂質奈米顆粒會在人體細胞中釋出 RNA,使人體細胞能自行產出病毒蛋白質片段,並活化免疫系統(圖一)。然而,在 mRNA 疫苗研究之初,要將 RNA 送進人體中有著兩大挑戰。首先,外來的 RNA 會被體內的類鐸受體(tolllike receptors, TLR)辨識,進而觸發先天性免疫發炎反應;其次,RNA 在人體內極易降解,難以送達目標細胞或器官。
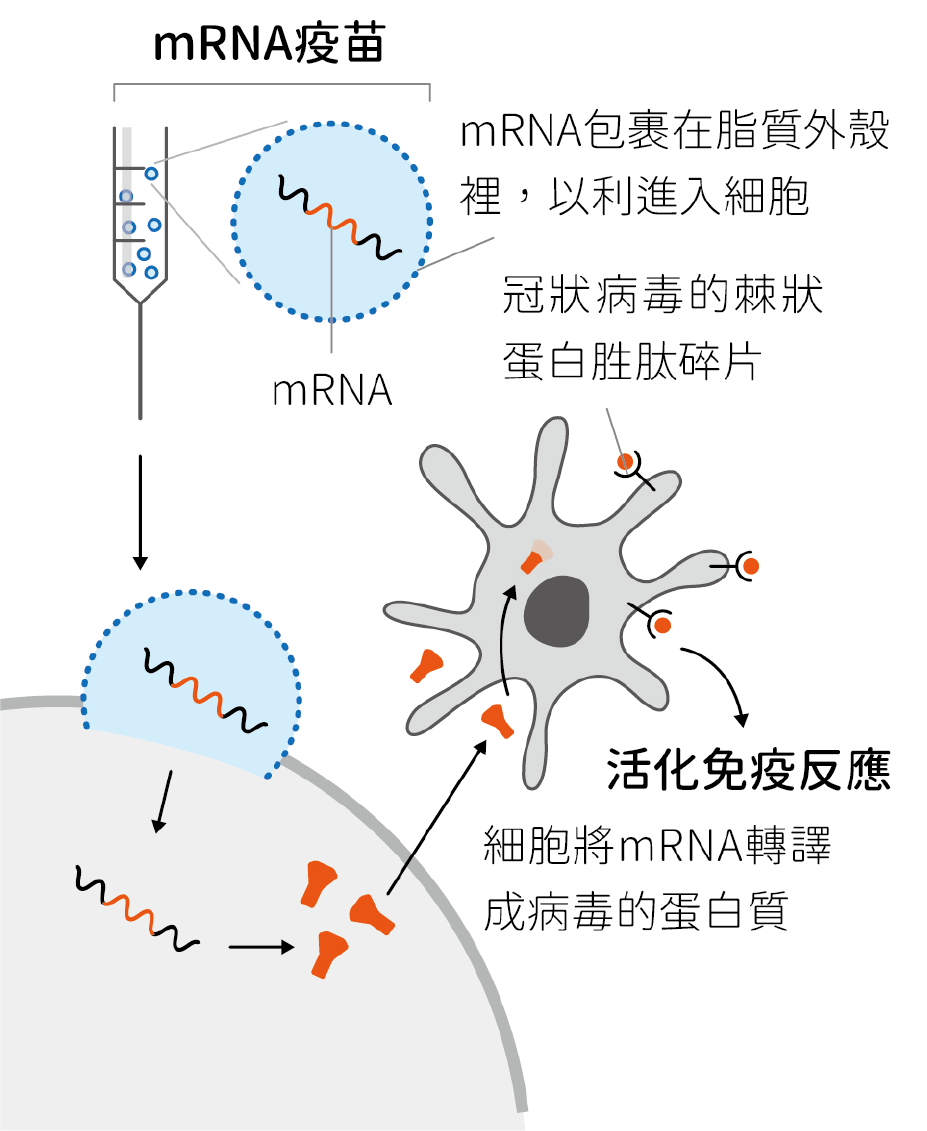
▲圖一:mRNA 疫苗設計原理
卡里科和魏斯曼:mRNA 核苷修飾技術
這也是為什麼即使科學家早在 1961 年就發現 mRNA 的存在,卻沒有人可以做出這個概念看似簡單、但在實作上卻困難重重的技術。1990 年代,任職於賓夕法尼亞大學(University of Pennsylvania)的卡里科全心投入 mRNA 的相關研究,並試圖了解 RNA 與免疫反應的機制。然而,由於當時普遍認為透過 RNA 引起免疫反應是一項無法應用的技術,所以她所做的研究並不被看好,也申請不到研究基金。直到 1997 年,原本任職美國衛生研究院(National Institutes of Health, NIH)的魏斯曼受聘到賓夕法尼亞大學跟卡里科成為同事,專長為免疫系統和疫苗開發的他很快就對卡里科的 RNA 研究感興趣,便邀請她共同合作。
往後他們一同研究,發現 mRNA 會被類鐸受體辨識,從而參與先天性免疫反應。若直接將 mRNA 注射到動物體內,會導致嚴重的發炎反應。但當 mRNA 的核苷經過修飾,如同一些自然存在的 RNA 一樣,就能逃脫免疫監測(immune surveillance),不會引發免疫反應。最終,他們成功找出了重要的修飾核苷技術,將尿苷(uridine, U)修飾為假尿苷 (pseudouridine, Ψ),以抑制 mRNA 的免疫原性(圖二 ③)。
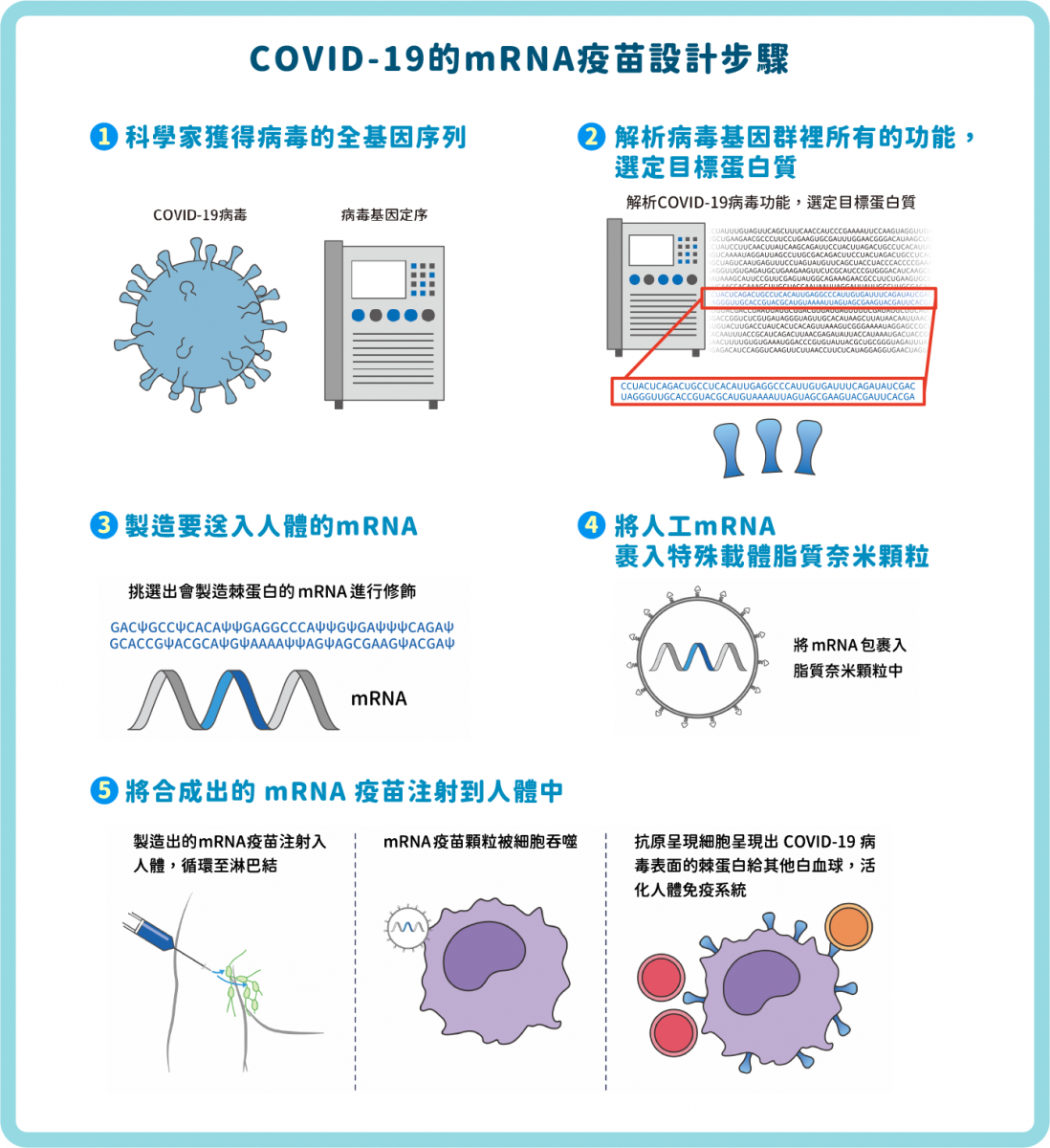
▲圖二
庫利斯:脂質奈米顆粒系統
克服了合成 mRNA 會被先天性免疫系統辨識而引發嚴重發炎反應的問題之後,第二關便是如何將不穩定的 mRNA 送入人體中,使細胞能自行產出病毒蛋白質片段。與卡里科和魏斯曼的背景不同,庫利斯是一位物理學博士,任職於加拿大英屬哥倫比亞大學(University of British Columbia),主要從分子層面研究膜結構和功能,以開發有效運送藥物的治療平臺。在 mRNA 疫苗的開發中,他製造了由 pH 值調控的陽性電荷脂質,能包覆帶陰離子的 RNA,形成脂質奈米顆粒(圖三),並透過細胞胞吞作用傳送至人體細胞,並確保它們在進入細胞之後才被釋放。
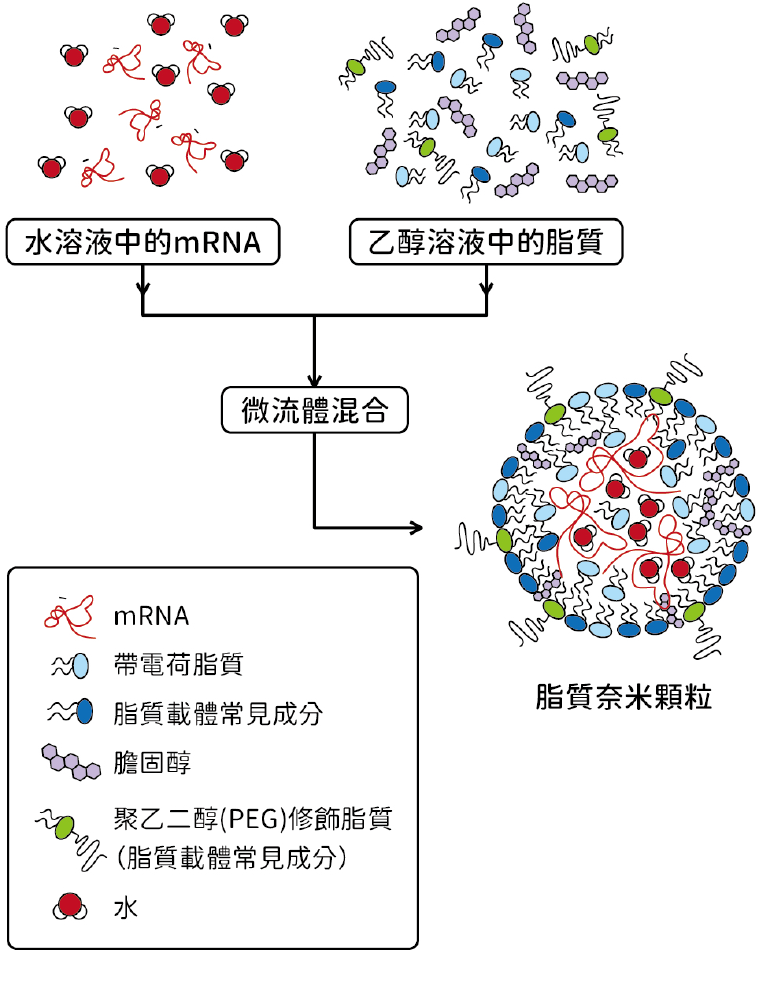
▲圖三:mRNA 疫苗的脂質奈米顆粒
耗時 20 年的漫漫研發路
mRNA 的相關研究起初並不被人看好,但即使如此,卡里科和魏斯曼最終仍完成這項看似不可能的任務,成功開發出 mRNA 疫苗。因此,唐獎生技醫藥獎評選委員會召集人張文昌院士表示,這次唐獎除了表彰他們在 mRNA 疫苗的開發貢獻外,更包含了他們多年來努力、堅持不懈的精神,「堅持、努力是我在他們身上看到的特質。」
研究之路一路走來崎嶇不平的卡里科,憑藉著對 mRNA 的執著和研究的熱情,即使一開始處處碰壁,但她不氣餒也不放棄,與魏斯曼兩人埋首研究,透過不斷地修正實驗,一點一滴累積各種研究結果、一步步找出問題的答案。如同魏斯曼在獲獎時所發表的感言,「如果你做了一個實驗,但你不理解結果,並不是實驗失敗了,可能代表你的理論不對,或者你對結果的理解是錯誤的。」即使從實驗中獲得很多他們不了解的數據,他們也不因此認為這些數據沒有用,而是從中找出問題的癥結。「我們會坐下來思考,試著去想如何才能理解這些數據要告訴我們什麼。」
做研究長達 50 年的張文昌院士也表示,「遇到實驗上非預期的結果時要告訴自己,它是在告訴我這個想法是錯誤的,非預期的結果才是對的,而如何去解決這個非預期的結果才是最重要的。」如同法國微生物學家巴斯德(Louis Pasteur)曾經說過的:「機會是留給準備好的人。」(Chance favors the prepared mind.)張文昌院士也讚譽卡里科就是一個「在機會來臨前做好準備,機會來臨時確實抓住機會」最好的例子。
mRNA 技術在新冠疫苗的成功,其實是一個意外插曲。張文昌院士提及,原本輝瑞與莫德納兩家公司期望將 mRNA 技術應用在治療癌症上,「只是大家都沒想到 2019 年底會爆發 COVID-19 疫情啊!」張文昌院士笑著說。兩公司在陰錯陽差之下投入新冠疫苗的研發,還因此加速 mRNA 技術的成熟。
此外,張文昌院士也表示,庫利斯其實在脂質奈米顆粒系統上已耕耘多年,他所開發的脂質奈米顆粒就曾被應用在一款罕見疾病藥 Onpattro(patisiran)上,此藥物可以用來治療遺傳性澱粉樣蛋白疾病(hereditary transthyretin amyloidosis, hATTR),已於 2018 年核准上市,這也是第一個獲得美國 FDA 核准的核醣核酸干擾(RNA interference, RNAi)脂質奈米顆粒藥物。「他利用四種不同脂質的組成製造出不同類型的脂質奈米顆粒,就能運送不一樣類型的分子或核酸藥物,在應用上很廣泛,所以他也開了很多公司,是多家公司的創辦人。」
一場科學家與病毒的競賽
mRNA 疫苗研發的成功,除了這三位科學家的貢獻之外,其實背後還有許多人的幫助,才得以讓 mRNA 疫苗在短時間順利完成並量產。張文昌院士也點名了當初和莫德納公司合作、任職美國國家衛生研究院的格雷厄姆(Barney Graham)、科貝特(Kizzmekia Corbett),「他們參與莫德納疫苗的開發時,找出能增加 mRNA 在細胞中穩定性的序列修飾,這個貢獻也十分重要,讓莫德納疫苗的保存方式與 BNT 疫苗的 -80℃ 相比,只需要保存在 -20℃。」
張文昌院士同樣也提到與輝瑞合作、創辦 BioNTech 公司的吳沙忻(Uğur Şahin)和圖勒奇(Özlem Türeci)夫婦,他們在疫苗開發的路上以及為疫苗的付出其實都功不可沒。張文昌院士強調,「這次生技醫藥獎主要是表彰『mRNA 疫苗的開發與製作』,但其實能讓疫苗成功也不只是這三個人,不過整體來說他們三位的貢獻是最大也最為關鍵。」
持續、永不停歇的科學路
即使已經成功研發出疫苗,但卡里科仍沒有停下腳步,除了在賓夕法尼亞大學擔任兼任教授外,她同時也是 BioNTech 公司的資深副總,並持續參與 mRNA 疫苗的改良。如同前面提到的 BNT 疫苗需保存在 -80℃,保存環境最為嚴苛。「目前 mRNA 疫苗不管是 -20℃ 或 -80℃ 運送上都很不方便,如果可以讓它更穩定,就可能保存在 4℃,甚至是常溫。」張文昌院士接著就與我們分享卡里科和 BioNTech 的最新研究,「他們目前是將脂質奈米顆粒凍乾(lyophilization),這項技術不只是能減輕疫苗的運送壓力,對於往後藥物的研發更是至關重要。」目前,這項改良技術也已發表在今年 5 月的《分子治療》(Molecular Therapy)期刊中。
臺灣的 mRNA 疫苗技術
至於臺灣 mRNA 疫苗的發展,就如同中央研究院(簡稱中研院)轉譯醫學專題中心執行長陶秘華在唐獎記者會上所述,雖然有團隊在進行相關 mRNA 技術和脂質奈米顆粒的研究,但是先前並沒有相互整合、共同合作開發。所以,臺灣現在正急起直追,積極地投入 mRNA 疫苗技術的研發。其中,中研院的 ALPHA mRNA 疫苗計畫在 2021 年已成功在實驗室中完成 Omicron mRNA 疫苗製造和實驗室效果驗證。
另外,在脂質奈米顆粒的應用方面,張文昌院士也提到不同的脂質組成能包裹的物質類型也不同,更會影響到它的功能。所以臺灣研究團隊也要努力找出包裹和傳輸效果更好的脂質奈米顆粒,因為這項技術不只是可以應用在疫苗的製作,甚至也包括抗癌、罕病等新藥的研發,「像是在核酸藥物的研發中,脂質奈米顆粒包裹的就不只限於 mRNA,也可以包含 siRNA,所以我們也要下點功夫,研發出我們自己的 LNP 技術。」
最後,談到 mRNA 疫苗的潛在未來,張院士表示,mRNA 疫苗技術的崛起,不只是改變疫苗的製作方式,甚至是顛覆了整個生物技術,也意味著它將成為未來我們在應對新興疾病時一個嶄新的應用平臺「這是一個全新的領域,雖然臺灣仍在起步階段,但只要努力追趕,一定還是有機會。」
延伸閱讀
Muramatsu, et al. (2022). Lyophilization provides long-term stability for a lipid nanoparticle-formulated, nucleoside-modified mRNA vaccine. Molecular Therapy, 30(5), 1941-1951.
⇠上一篇:讓材料在奈米尺度下重獲新生,提高色彩解析度的量子點
ChatGPT 時代下, 教師如何帶領學生探索運算思維?:下一篇⇢
本文轉載、修改自《科學月刊》2022 年 8 月





















