CRISPR-Cas9
黃子懿∕臺灣大學醫學系二年級生。
陳佑宗∕臺灣大學基因體暨蛋白體醫學研究所副教授。



2020 年諾貝爾化學獎由美國生化學家道納(Jennifer Doudna)和法國微生物學家夏彭提耶(Emmanuelle Charpentier)共享殊榮,兩人因「開發編輯基因體的方法」而獲獎。事實上,兩位致力研究的是近年相當熱門的 CRISPR-Cas 基因編輯系統。接下來,我們將從 CRISPR 的源頭開始介紹,探討道納和夏彭提耶如何發現 CRISPR-Cas 運用於基因編輯的可能性,並舉例說明這項研究對生物與醫學領域的影響。
回到源頭——細菌基因體中神祕的重複序列
1987 年,日本科學家發現大腸桿菌(Escherichia coli)基因體中有不尋常的重複序列。這些片段的序列完全相同,具有回文性質(palindrome),且彼此間固定間隔一段特殊序列。後來,科學家發現這是原核生物基因體中常見的結構,便依其特性而命名為常間回文重複序列叢集(Clustered Regularly Interspaced Short Palindromic Repeats, CRISPR)。
之後,他們推斷這段重複序列像是細菌的免疫系統,當細菌遭噬菌體感染卻幸運存活時,便會切取一小段噬菌體的 DNA,並儲存於 CRISPR 之間的間隔序列(spacer)。如果未來再次遭到噬菌體感染,由這些間隔序列和 CRISPR 重複序列所轉錄出的 crRNA(CRISPR RNA),會連同一群稱為 Cas 的蛋白質去識別此噬菌體,並摧毀其 DNA,科學家稱此破壞噬菌體基因的過程為干擾(interference,圖一)。
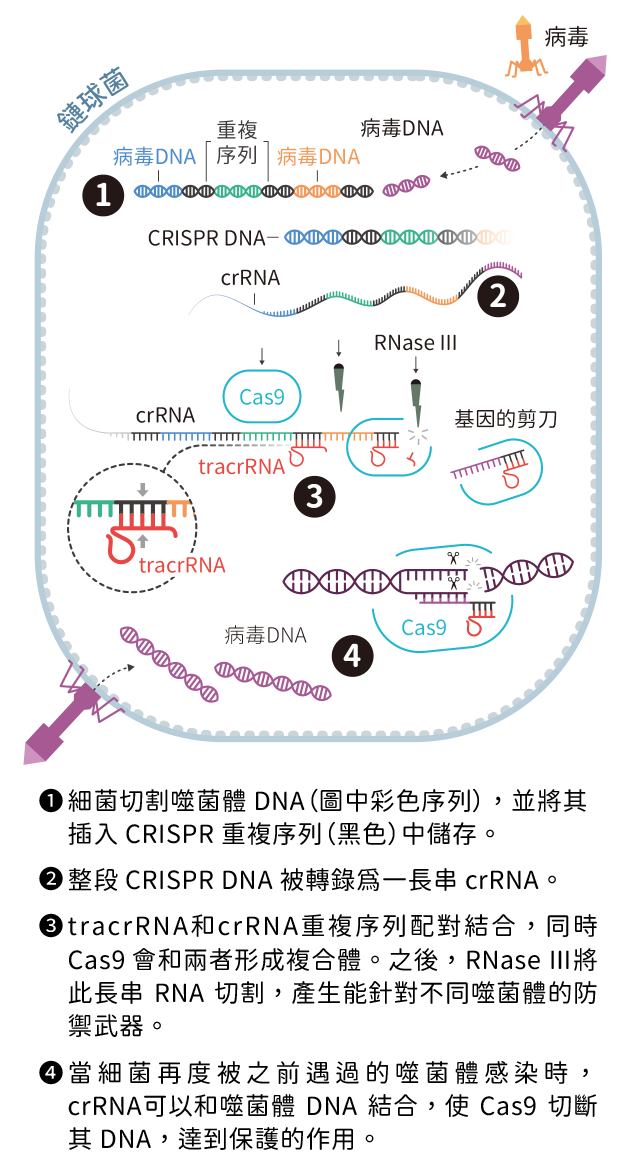
▲圖一:鏈球菌中 Class Ⅱ CRISPR/Cas 機制圖
在不同細菌中,CRISPR-Cas 的運作模式也不盡相同,主要可以分為兩大類:Class I 和 Class II。兩者最大的差異在於進行干擾時,Class I 需要多種 Cas 蛋白共同參與,有的負責鎖定目標核酸,有的則負責切割。而 Class II 則較為簡潔,只需要一種具有多個區域(domain)的 Cas 蛋白,就像是融合多種工具的瑞士刀,能執行干擾過程所需的各種功能。然而,細菌這樣的機制和基因編輯該如何產生關聯?這正是道納、夏彭提耶和她們團隊的重要突破。
道納好奇接觸 CRISPR
在夏威夷長大的道納,自幼即對大自然充滿疑問與好奇,中學時,她讀了諾貝爾生理醫學獎得主華森(James Watson)的著作,激發她對生物化學的興趣。1994 年,她在耶魯大學(Yale University)成立實驗室,兩年後即因確定一種 RNA 酶(ribozyme)的結構,而發表於《科學》(Science)期刊並獲得學界關注。之後,她到加州大學柏克萊分校(University of California, Berkeley),繼續研究 RNA 及 RNA 干擾(RNA interference, RNAi)。在那裡,她第一次接觸到 CRISPR 這個當時相當冷門的領域。
2006 年,同在柏克萊分校的地球科學家班菲爾德(Jillian Banfield)來電,想邀請道納加入研究 CRISPR 的行列。完全沒聽過這個名詞的道納閱讀了當時相當有限的資料,而好奇於這特殊的干擾機制以及 Cas 酵素的潛在功能,於是她答應了邀約,並著手研究 Class I CRISPR-Cas。2009 年,她的團隊發現一種能切割 DNA 的 Cas1 蛋白,並推測這種酵素可將噬菌體 DNA 插入 CRISPR 陣列中,等同免疫記憶的形成。之後,她逐漸將重心放在 Cas 蛋白如何切割病毒 DNA。儘管屢有突破,道納仍知道自己研究的侷限性,她希望能更瞭解較為簡潔的 Class II CRISPR-Cas,而遇見夏彭提耶正好提供了新的研究機會。
夏彭提耶與化膿鏈球菌
遠在地球另一頭的夏彭提耶,成長於法國巴黎附近的小鎮,小時候即立定志向希望能對醫藥界有所貢獻。曾在 1996 年至美國紐約洛克斐勒大學(Rockefeller University)和微生物學家托曼能(Elaine Tuomanen)研究肺炎鏈球菌(Streptococcus pneumoniae),托曼能曾稱讚她「總在尋求基因體中的意外發現」。2002 年,她返回歐洲,在維也納大學(University of Vienna)研究化膿鏈球菌(Streptococcus pyogenes)的致病性,她也開始思考 CRISPR 的機制。由於她的團隊先前曾找到調節化膿鏈球菌致病因子的 RNA,使她開始好奇化膿鏈球菌基因體中哪些區域會轉錄出調節 RNA(regulatory RNA),以及這些區域和 CRISPR 是否有關聯。
在和同事佛格爾(Jörg Vogel)合作下,他們意外觀察到一種大量表現且當時未知的非編碼 RNA(non-coding RNA),位置在 CRISPR 陣列上游,且轉錄方向相反,他們稱之為 tracrRNA(trans-activating CRISPR RNA)。進一步研究 tracrRNA 的序列,發現其會和 crRNA 配對在一起。之後,他們利用實驗證明 tracrRNA 和 crRNA 的成熟相關,且此機制涉及 Class II CRISPR-Cas 的 Cas9 蛋白(舊稱 Csn1)。此研究成果於 2011 年刊登在《自然》(Nature),由於過去科學界並沒想過 CRISPR 系統可能有兩種 RNA 分子共同參與,因此引起熱烈討論。
跨國團隊——《科學》期刊的震撼彈
2011 年春天,道納與夏彭提耶兩人一同到波多黎各參加美國微生物學會的年會。素昧平生的兩人,在共同朋友介紹下相識,兩人漫步於波多黎各首府聖胡安舊城區並聊起了自己的科學研究。夏彭提耶於是向道納提出合作計畫,希望結合道納在生物化學與結構生物學知識,一同釐清 Cas9 蛋白的功能。受到化膿鏈球菌中 Class II CRISPRCas 吸引,道納很快便接受邀請,仍在柏克萊做研究的道納,便與剛搬到瑞典于默奧大學(Umeå universitet)的夏彭提耶,開啟了跨國合作。
當時已知道 Cas9 對於細菌的 CRISPR 免疫運作相當重要,但其真正的角色仍不明,由過去文獻以及 Cas9 胺基酸序列分析,兩人的跨國團隊推測 Cas9 應該會受 crRNA 引導而切割外來 DNA。於是,道納的實驗室利用重組 DNA 的技術,在大腸桿菌中生產大量的 Cas9,再利用不同的層析方式純化出 Cas9。接著,他們將 Cas9、病毒 DNA 與 crRNA(其序列能和一段病毒 DNA 互補)混合,檢驗其假說是否正確。遺憾的是,實驗結果顯示病毒 DNA 並未受到切割。儘管如此,他們並未氣餒,不久後便有了重要發現:多加入夏彭提耶等人先前找到的 tracrRNA,便能使 Cas9 切割病毒 DNA 上和 crRNA 互補的序列!
接下來,兩人的團隊便好奇:是否可以透過改寫 RNA 序列來引導 Cas9 切割任何 DNA?為了測試此推測,他們首先設計一段 RNA 來連結 crRNA 和 tracrRNA,這段 RNA 會形成像髮夾的特殊立體結構(hairpin),使得 crRNA 和 tracrRNA 原本互補配對的結構不會受到影響,這樣的合體 RNA 稱為單一嚮導 RNA(single-guide RNA, sgRNA,舊稱 single chimeric RNA)。接著,他們從綠螢光蛋白(green-fluorescent protein, GFP)的基因挑選 5 段 20 個鹼基對長的序列,依次合成 5 個單一嚮導 RNA,再將 Cas9、sgRNA 和帶有 GFP 基因的質體混合。結果顯現所有 GFP DNA 都如預期地被切斷,這表示他們開發了一種只需兩個零件(Cas9 和 sgRNA)的基因編輯工具!興奮的團隊隨即統整實驗結果,將研究文章投稿至《科學》,短短二十天內即刊登,震撼科學界。幾乎在同一時間,立陶宛的希克席尼(Virginijus Šikšnys)團隊亦發表了類似的結果,卻成為本次諾貝爾獎的遺珠。
CRISPR-Cas 的未來與應用
CRISPR-Cas 相較於過去其他基因編輯工具(如鋅指蛋白或 TALEN)更為簡便,只需更改 sgRNA 前端 20 個鹼基對的序列,便能標靶不同基因,甚至能同時編輯多個基因。如今,有眾多科學家嘗試將 CRISPR-Cas 應用於不同層面,除了過去常提及的基因治療(gene therapy)和農作物改良外,在生物及醫學還有更多應用。例如,有團隊用 CRISPR-Cas9 在蚊子中進行基因驅動(gene drive),這是一種能使特定基因在族群中快速傳播的基因工程。他們修改蚊子某個和繁殖有關的基因,使其不孕,再將少數基因修改過的蚊子,放入野生型蚊子的籠子中,成功在八到十二代內使整個族群不孕,這項技術有望用於防治蚊子傳染的登革熱、瘧疾等疾病。事實上,比爾及梅琳達‧蓋茲基金會(Bill & Melinda Gates Foundation)底下的瘧疾計畫(Target Malaria),即投入高達 7,500 萬美元研究 CRISPR-Cas9 基因驅動。
另外,哈佛大學的邱吉(George Church)則成功利用 CRISPR-Cas9 剔除豬基因體中 62 段序列。這些序列主要為內源反轉錄病毒序列(endogenous retrovirus),是移植豬器官至人體的一大阻礙。邱吉之後更創立了 eGenesis 公司,持續進行此計畫。如果未來成功剔除所有相關序列,可藉此提高豬器官移植的安全性,來幫助等不到合適器官捐贈的病人。由上述可見,CRISPR-Cas 豐富的應用勢必將持續影響生命科學及醫學的研究發展。
純然的好奇心與意外的解答
CRISPR-Cas 的研究最初只是來自純然的好奇心,想了解細菌所演化出的巧妙防禦機制,卻意外找到基因編輯的工具,對於生物醫學領域造成衝擊。如同道納在受獎後所言「問題的解答常來自意外的方向」,此次諾貝爾獎給予 CRISPR-Cas 肯定,說明了基礎研究的重要性,也見證了自然萬物的奧妙。相信未來會有更多科學家,憑著好奇心、原創性和團隊合作,在基礎科學研究中找到重要突破。
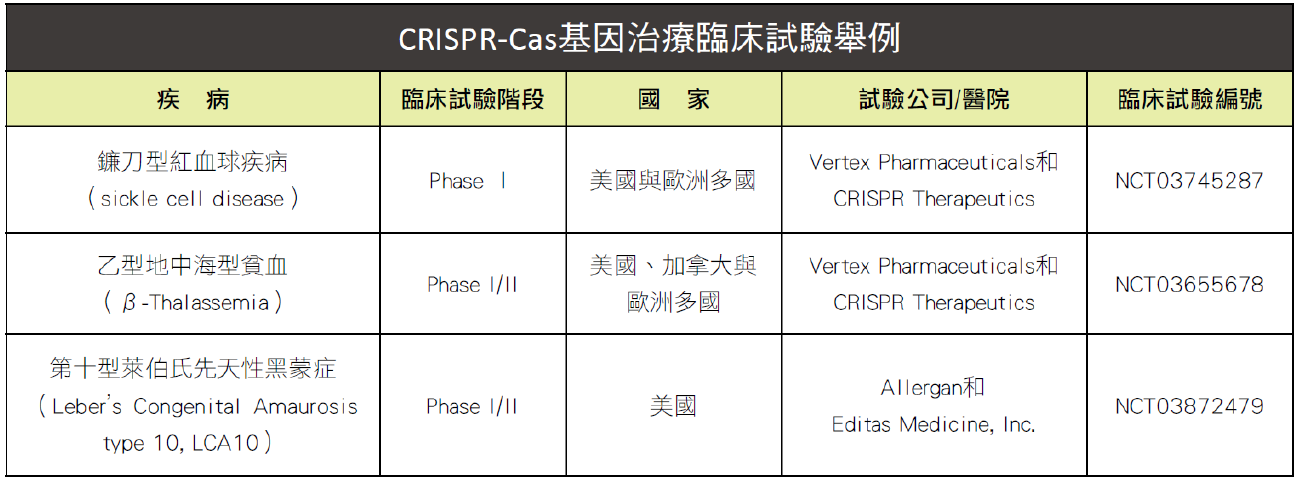
▲CRISPR-Cas 已經漸漸走到臨床應用上,但目前仍處於臨床試驗早期,離實際應用還有一段距離。除了表中列出的遺傳疾病外,有些團隊則嘗試將 CRISPR-Cas 結合免疫療法,未來有望用於癌症治療。
延伸閱讀
1. Elitza Deltcheva et al., CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III, Nature, 471(7340), 602-607, 2011.
2. Giedrius Gasiunas et al., Cas9–crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences, 109(39), E2579-E2586, 2012.
3. Martin Jinek et al., A programmable dual-RNA–guided DNA endonuclease in adaptive bacterial immunity. Science, 337(6096): 816-21, 2012.
⇠上一篇:基因編輯技術CRISPR的應用在倫理道德上有何挑戰?
直衝雲霄的高樓競賽:下一篇⇢