在倫理道德上有何挑戰?
陳淵銓∕美國加州大學柏克萊分校生物化學博士。
近幾年來,叢集有規律間隔的短迴文重複序列(clustered regularly interspaced short palindromic repeats, CRISPR)成為科學界的熱門話題之一,其原為存於細菌的後天免疫系統(adaptive immunity),現已發展為一種成功的基因編輯技術。
CRISPR 到底是什麼?
圖一為 CRISPR-Cas9 的作用機制。從圖上來看,單股導引 RNA(single-guiding RNA, sgRNA)與 Cas9 蛋白的交互作用後,引導內核酸酶(endonuclease)的活性作用到一「與原間隔序列鄰近的區域(protospacer adjacent motif, PAM)」;而 sgRNA 負責辨認專一性的 DNA 序列,所結合的 Cas9 蛋白會裁切在 DNA 正反兩股 PAM(NGG)上游各 3 個核苷酸的位置,形成鈍端(blunt end)的雙股斷裂 CRISPR 與傳統基因編輯技術相較,同時具有無物種限制、簡單、準確、迅速及經濟的特性,除已成功用於基礎研究外,亦應用於生產農產品、食品、工業產品及醫藥品等,其中醫藥品的開發更將引領人類醫療進入全新的領域,為眾多罹患難解之症的病人,帶來康復的一線曙光。雖然說 CRISPR 技術應用範圍日漸廣泛,但仍有許多挑戰尚待克服(表一)。
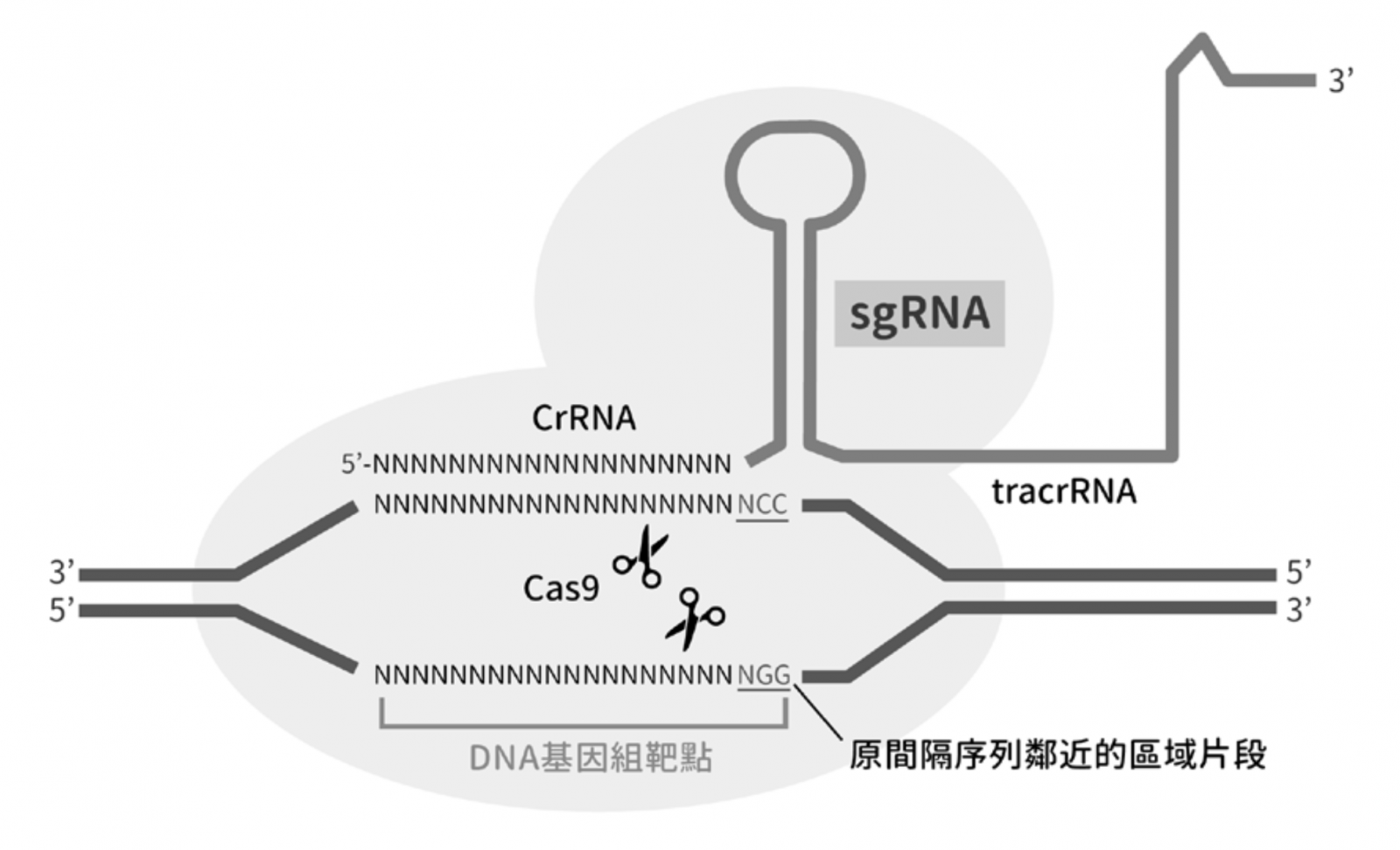
▲圖一:CRISPR-Cas9 作用機制示意圖。

▲表一:CRISPR 的應用與挑戰一覽表。
以下就 CRISPR 技術應用於基礎研究、非醫療及人體醫療三個領域所產生倫理、道德和法規上的挑戰,分別加以討論。
技術應用帶來的挑戰是什麼?
基礎研究上,操作 CRISPR 的過程中會產生待處理的廢棄物,而專利申請與技術發展間的拉扯也存在諸多爭議。
在實驗室做 CRISPR 研究,必然會使用到有毒性的傳遞工具(delivery tool),因為無法完全避免脫靶(off target)效應發生,也一定會產生突變物。這些有毒物質及突變物若釋出,可能對環境或生態造成衝擊,但相關單位對此種廢棄物的紀錄、處理及管制措施執行並不容易落實。
此外,CRISPR 技術具有潛在的高利潤性,雖說非醫療產品通常採非獨家授權生產,但目前在人體治療上則幾乎均為獨家授權生產。由於發明者持有專利,基於利益考量,往往保密不對外公開,可能會妨礙到科學的進一步合作與交流,使得技術無法再創新,研究成果僅局限於一隅,而專利的爭奪亦會造成社會的紛爭與撕裂。
雖說 CRISPR 在非醫療應用上相當廣泛,但仍存在一些疑慮,不僅可能對環境與生態產生威脅,以該技術改造出來的食品是否安全也備受關注。
利用 CRISPR 技術製造農產品、食品及工業產品時,過程中會使用或產生大量化學、生物性的有毒物質,若未經適當處理即排出,會對環境造成嚴重汙染。此外,該過程中可能會產生突變的動、植物或微生物,若不慎釋出到野外,可能會排擠本土生物的生存,或與現有正常生物進行雜交而產生無法預期的物種。
眾多 CRISPR 技術存在的隱憂裡,最大的爭議莫過於「基因改造食品(genetically modified organism, GMO)」是否對人體健康有害。目前正反意見都有,贊成者認為有害證據不足,反對者則認為仍有相當風險存在,例如外來基因可能轉移到自身體內、非專一性表現產生的蛋白質恐引起過敏和免疫毒性等。現今國際對 GMO 的定義並不一致,有的國家(如美國)認為若僅為修改現有基因,而不引進外基因即非 GMO;有的國家(如歐盟)態度較保守地認為 GMO 是「除人類以外的生物,其遺傳物質的改變非由自然配對(mating)和/或自然重組(recombination)的方式」所形成的產物。然而,對所謂明確定義 GMO,規範管理模式為製程導向抑或產品導向,決定非 GMO 及 GMO 的管理方式,相關法規的制定將是相當複雜且充滿爭議的。
另外,該技術的實踐也有倫理上的考量。以 CRISPR 技術復育絕種生物(如長毛象、北美旅行鴿、恐鳥),或複製死去的寵物(如貓、狗等),讓其死而復生,技術上雖然可行,但均須借用現存類似動物(如亞洲象、家鴿、鴕鳥)或相同動物的身體作為代理孕母。人類為滿足預期期待與個人慾望而逕行利用其他動物身體,恐有違反實驗動物福祉的 3R 原則──取代(replacement)、減量(reduction)以及精緻化(refinement)。
當 CRISPR 技術進到人體醫療方面做應用時,其隱憂更容易讓人感同身受,包括風險評估、個人與群眾利益的考量以及醫療商業化導致的倫理問題。
CRISPR 技術固然帶來許多實質利益,但亦引發不少潛在風險,使得風險評估複雜化。為確保利益大於風險,發展可評估利益和風險比率(benefit-risk ratio)的公式並規定可接受的閥值(threshold)是必要的。然而,在制定風險評估系統時,須擴大利益相關者(stakeholder)意見參與,專業觀點的差異及引發的利益糾葛卻是難以解決的。
該技術的出現,可能還伴隨著私利和公益失衡的問題。個人利益固然要受到保護,但要對公眾有所貢獻,公共利益也才能夠反饋給個人。然而,如何兼顧私利和公益並保持平衡卻是個難題,舉例來說,為保障個人利益,應對研發者提供何種誘因(如專利、證照、聲望、榮耀、利潤等);為促進公共利益,應如何將獨家授權的證照限制在最小的範圍、加速專利權限制鬆綁、促成各競爭者進行證照交換(cross license)及鼓勵利益相關者達成協議以規範彼此的權利義務等。
此外,這項技術應用於人體治療所具備的高度科學、專一、客製化及費用龐大等特性,促成個人化的精準醫療(precision medicine),也讓醫療更趨商業化。為確保醫療人權,須讓有需求的病人均可獲得治療,而非成為少數人的特權或優先權。然而,設計一個病人、付費者及醫療機構均能接受的保險和付費制度,卻是一個經費龐大的社會安全系統。
更驚人的是,由於 CRISPR 技術可成功用於矯正先天性遺傳疾病,最近的研究更發現可以編輯人類胚胎基因,雖目的僅為治療某種特定疾病與生理障礙,但市場商業化的結果也可能促使技術轉往訂製嬰兒的方向發展,恐加劇社會的不公平、階級的對立及人生而不平等的疑慮。
一些案例討論
基因編輯工具發展至今,已出現許多相關應用,包括基因治療、器官移植與動物的複製等。即便可以透過這項技術改變一個物種的「宿命」,但該做法仍存在諸多爭議……
基因治療與細胞治療
所謂基因治療即利用基因編輯技術(如 CRISPR)與傳遞工具(delivery tool)將特定基因導入人體或胚胎中,以刪除、嵌入、修補或置換變異基因,或造成位置專一性修飾(site-specific modification),達成標靶治療(target therapy)的目的。細胞治療則是取人類自體﹙autologous﹚細胞或同種異體﹙allogeneic﹚細胞,經基因編輯技術加工處理及體外培養後,再將整個細胞引進病人體內,以修補、重建、置換或補充受損的細胞或組織。
基因治療最初主要用於治療先天性遺傳性疾病,細胞治療則主要用於抑制骨髓、器官移植時引起的排斥(rejection)反應。然而,近來這兩個介入亦逐漸發展成適用於其他疾病,如心血管、代謝性、神經退化性疾病及癌症等,連同組織工程(tissue engineering)產品,在國外被列為先進醫療產品(advanced therapy medicinal product, ATMP)。
兩種治療方法的研究雖已獲顯著成果並已有多種產品應用於臨床,但在倫理、道德上仍存有相當多的挑戰(表二)。
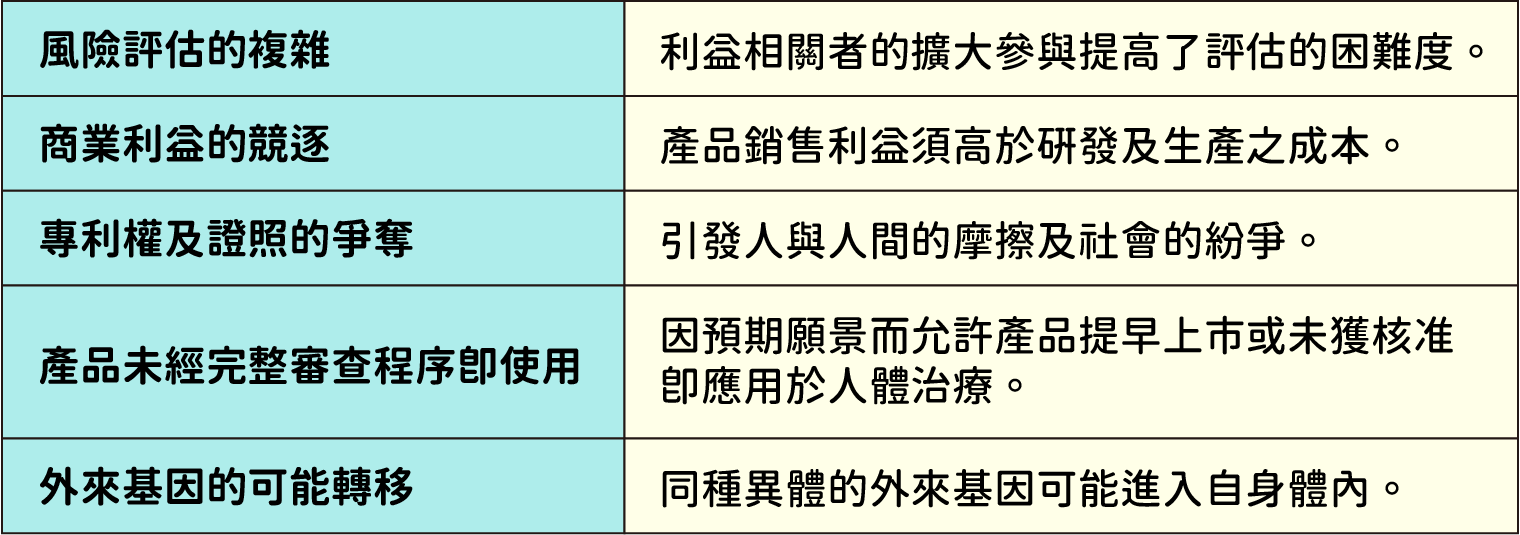
▲表二:基因治療與細胞治療在倫理、道德面上所遭遇的挑戰。
基因編輯嬰兒
2017 年,貝格雷(Sharon Begley)研究發現 CRISPR 技術可於活體外編輯人類胚胎基因,藉由剔除標靶的人類染色體基因來治療新生兒先天性缺陷。以該技術編輯人類生殖譜系細胞(germline cell,如精子、卵子和受精卵)已被證明在技術上是可行的。
2018 年 11 月,中國南方科技大學生物系副教授賀建奎宣稱以 CRISPR 技術修改一對雙胞胎胚胎的 CCR5 基因,讓孕母成功產下全球首對愛滋病(acquired immunodeficiency syndrome, AIDS)免疫雙胞胎。基因編輯結果可遺傳至下一代,引發全球科學界譁然,卻也存在一些爭議。
從技術風險來看,一般來說人類免疫缺陷病毒(human immunodeficiency virus, HIV) 可分為兩個亞型, 其人體受體(receptor)分別是 CCR5 和 CXCR4,若僅編輯 CCR5 基因,難以確保絕對安全;在未評估其是否有其他功能的前提下,以人工方法干預正常的 CCR5 基因,可能造成其他後遺症。此外,由於 AIDS 為傳染性疾病而非先天性遺傳疾病,以基因編輯技術產生 AIDS 免疫嬰兒,必要性與正當性受到強烈質疑,有訂製嬰兒的疑慮。
人體器官移植
全球有器官移植醫療需求的病人總數高達數百萬,主要來源為屍體摘取或活人捐贈,均必須是自願、無償且符合法規嚴格規範的,故每年獲移植者可能不到 1%,器官捐贈一直有很大的需求。
幹細胞是一種原始且未分化的細胞,具有再生各種細胞或組織、器官的潛在功能。導入特定基因或基因產物(蛋白質)後,成熟的細胞可以被重新編程為具有多功能分化性的幹細胞-誘導性多功能幹細胞(induced pluripotent stem cell, iPSC),利用基因編輯技術(如 CRISPR)技術修改 iPSC 特定基因植入其他動物體內,具有培養出人體特定器官的可能性(圖二)。技術上雖然具有可行性,但是人造器官目前在法規適用、倫理道德考量、病人心理及社會觀感上仍存在極大的爭議。
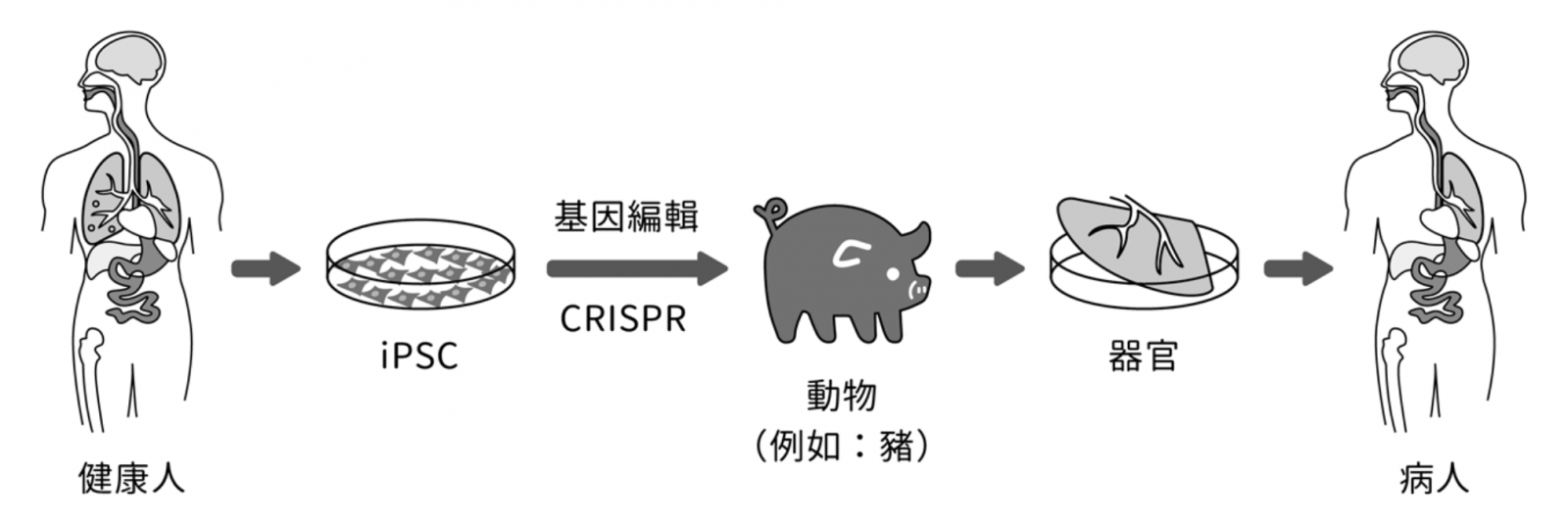
▲圖二:利用 CRISPR 修改 iPSC 基因可能在其他動物體內培養出人體器官。圖片來源/維基百科,iPSC
複製動物
禁止複製人的研究是有國際共識的,但基於研究需要,多種複製動物(如羊、牛、豬、小鼠、馬、猴子及貓等)已陸續成功誕生。複製羊桃莉(Dolly)是第一個成功複製的哺乳動物,共有三個母親:一個提供體細胞 DNA、一個提供卵子,一個則是代理孕母。
早期研究認為,桃莉羊僅活了 6 歲半(綿羊平均壽命約有 12 歲,壽命應從母體年齡算起)。這種早衰是技術因素導致,可透過基因編輯技術使其更長壽,惟 2017 年《科學報導》(Scientific Reports)一研究報告顯示,桃莉羊的死亡與早衰並無必然關係。複製動物原本的預期功能是解開複雜的疾病結構、找到治療不孕症的療法或使寵物死而復生,但後來因技術問題或倫理、道德爭議而均告失敗。
儘管如此,以類似複製動物的粒線體基因轉移技術可用於治療粒線體基因缺陷。人體粒線體基因均來自母代,研究報告已顯示粒線體功能失調與許多疾病密切相關,包括癌症、神經退化疾病、神經肌肉病變、肥胖與糖尿病等,而粒線體基因發生突變恐導致帕金森氏症(Parkinson’s disease)、罕見疾病萊氏綜合症(Leigh syndrome)、認知障礙、耳聾及雷伯氏遺傳性視神經萎縮症(Leber hereditary optic neuropathy)等病症。若施以粒線體置換療法(mitochondrial replacement therapy, MRT),利用捐贈者卵子的正常粒線體來替換原來胚胎或卵子中有缺陷的粒線體,便可使攜帶缺陷粒線體的母親有機會生下健康的嬰兒,且胚胎粒線體基因會以母系遺傳的方式延續下去(圖三)。
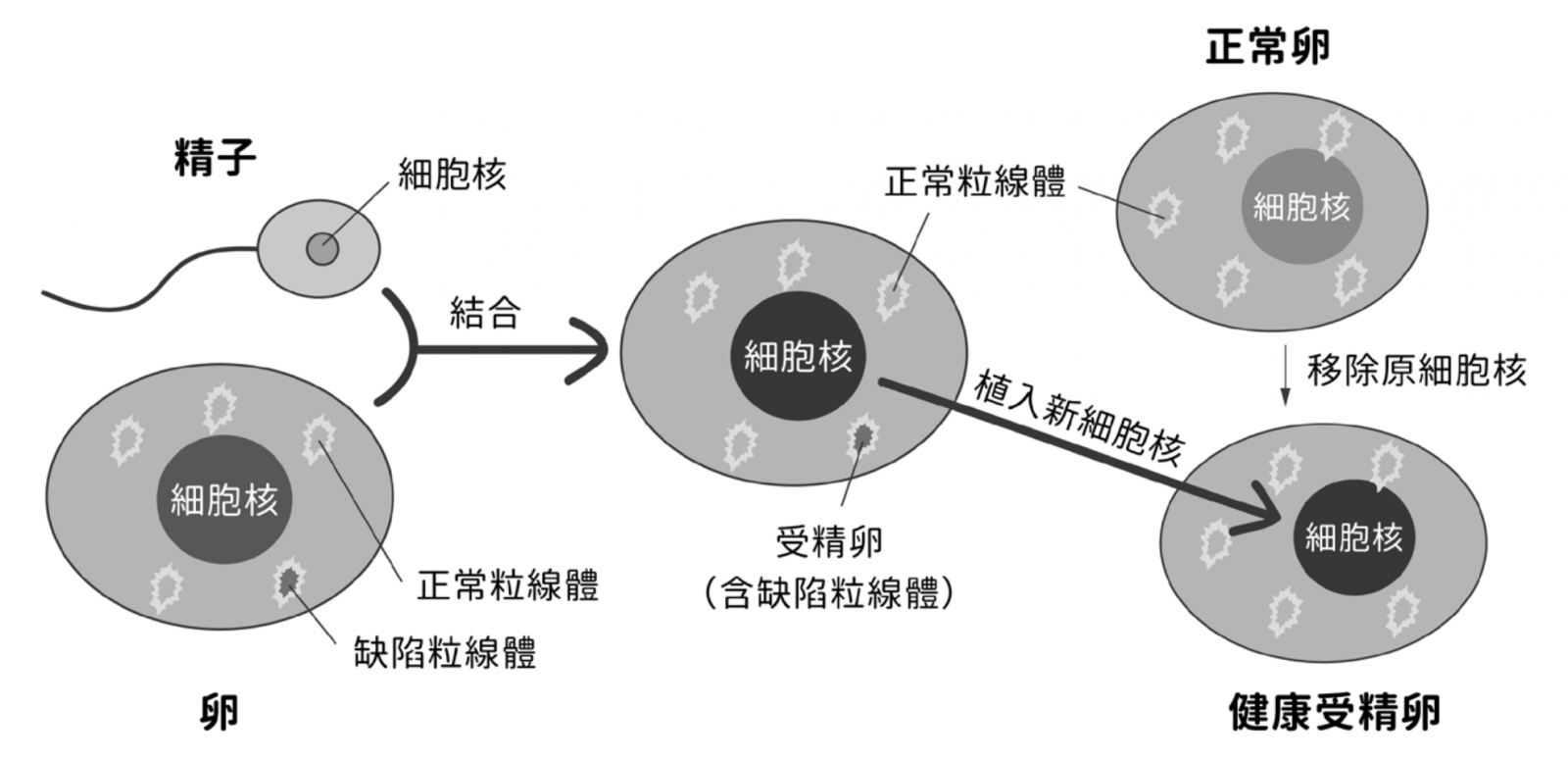
▲圖三:「粒線體置換療法」為將受精卵的細胞核植入含正常粒線體的卵(已先移除原細胞核),以創造無粒線體基因遺傳疾病的健康胚胎。
雖然粒線體基因僅佔人類全部基因不到 1‰,但經由 MRT 產生的後代將會攜帶來自「一父二母」三親代的 DNA,第三人基因是否會對孩童造成影響,仍無定論,是需要繼續探討的問題,因此 MRT 仍有極大的倫理爭議,目前國際上僅有英國(2015 年)及新加坡(2018 年)明確合法化 MRT 技術。目前,CRISPR 技術已可成功用於編輯人類精子、卵子及胚胎的基因,科學的進展或許會使該技術在不久的將來,亦可用來矯正卵子或胚胎的粒線體基因,提供解決此一難題的可行方法。
結論
禁止基因編輯技術應用於複製人及訂製嬰兒研究是全世界的共識,可是最近越來越多研究結果顯示,基因編輯技術對於治療某些以往難以根治的疾病深具潛力,特別是遺傳性疾病的基因治療。因此,國際學術界及醫療界普遍支持基因編輯技術應用於改造人類胚胎以治療先天性遺傳疾病,爭取在胚胎階段即矯正有缺陷的基因,以降低治療難度及成本,但亦認為涉及人類生殖譜系細胞的基因編輯須在最嚴格法規架構及機構倫理審查(Institutional review board, IRB)條件下方得進行。利用 CRISPR 技術修改 iPSC 基因,雖有可能生產人造器官供應病人所需,但並不符合目前我國法規(如人體器官移植條例及人類胚胎及胚胎幹細胞研究倫理政策指引等)的規定,若能考量病人的等待時間及器官移植的急迫性與必要性,並經過嚴格的評估及技術、倫理審查後,應有放寬規定的可行性。此外,進行 CRISPR 技術主導的人體治療(如基因及細胞治療、胚胎基因改造、器官移植及 MRT 等)時,為維護病人權益,應充分告知疾病的性質、治療的利益、成功率、可能風險、是否影響生活品質及可能衍生的倫理問題等相關資訊。
CRISPR 技術應用到一般生物(動物、植物及微生物)引起的倫理、道德議題較少,主要是安全問題(如環境汙染、生態浩劫或食品安全等),但應用到人體上則會引發重要的倫理及道德爭議。國內 CRISPR 相關的基礎研究已有相當進展,實應加強研究倫理、道德議題,邀集社會各界人士(如醫療、法學、倫理學、社會學、心理學專業人員及動物保護人士等)進行公開討論,作充分的溝通協調,提出制定或修正相關法規的建議,以解決可能衍生的問題,避免不利的影響,並開創美好的遠景。
⇠上一篇:在玩轉基因之後豬為人類帶來哪些醫學希望?
神奇的基因剪刀手CRISPR-Cas9:下一篇⇢