豬為人類帶來哪些醫學希望?
杜清富∕農業科技研究院動物科技究所。
豬隻與人類同為雜食動物,在營養代謝、生理功能及組織器官解剖構造,非常接近人類。除了非人靈長類外,豬隻被視為最接近人類的醫學實驗動物,過去曾提供胰島素及肝素,且長久以來提供心瓣膜、豬皮膚敷料、去細胞眼角膜及小腸基質等諸多醫藥或醫療器材,因此,豬在生物醫學及生物技術上,一直被學者視為極具基礎科學及生醫產業價值的研發對象。
前言
近年來,在生物學領域中最亮眼的進展是基因轉殖(transgenesis, Tg)、基因編輯(gene editing, GE)、誘導型多潛能幹細胞(induced pluripotent stem cell, iPSC)以及體細胞核轉置(somatic cell nuclear transfer, SCNT)的複製動物(animal cloning)等技術應用。基因轉殖直接跨越基因交換物種間限制,複製動物使已分化細胞重新成為個體;過去進行基因剔除(knockout, KO),是藉由胚胎幹細胞(embryonic stem cell, ESC)及同質重組反應(homologous recombination, HR),不過卻有效率低、技術門檻高等缺點及限制。因此,若能結合上述技術的研發,將更能提升豬隻在人類醫學研究、醫藥、醫療器材及組織器官的應用潛力,以下將簡述此等技術及如何配合應用到以豬為主體的研究上,乃至涉及社會倫理議題。
基因轉殖與複製
哺乳類的精子與卵子各會攜帶一套遺傳物質,在受精後進行 DNA 複製並形成原核(pronuclei),若在受精卵於原核複製時進行 DNA 剪接修補作用,如將外源基因藉由顯微注射至原核內(圖一),即可成功產製基因轉殖動物,以出生動物為計算基礎其成功效率可達 10~20%。基因轉殖豬在生物醫學最具研發潛力是異種器官移植,不過需克服複雜的免疫排斥反應及凝血反應,所以除基因轉殖外,還需進行基因剔除。以往的方法為將抗原進行基因剔除,培養早期豬胎體細胞進行同質基因重組,獲得免疫抗原剔除基因後,再將基因剔除的細胞核藉由體細胞核轉置到放入卵內,藉由卵中豐富發育因子及電極激活基因重新表現(reprogramming),產生基因剔除複製豬。不過 2011 年起,學者開始應用基因編輯技術,能簡化繁雜技術及提高成功率,甚至可直接使用豬受精卵進行。
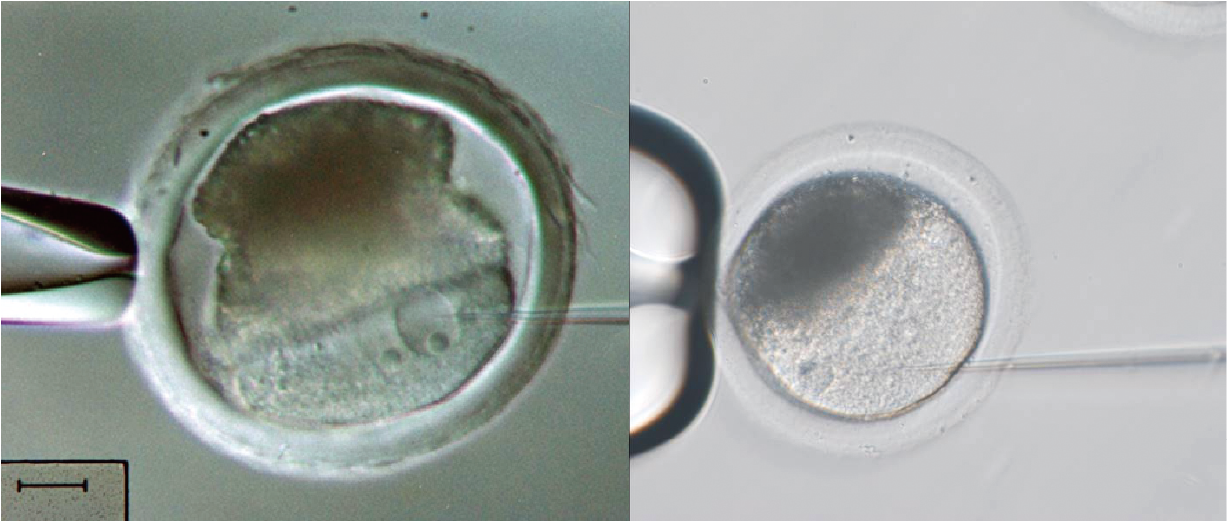
▲圖一:豬受精卵顯微注射。將基因編輯後的 DNA 載體注射至原核(左),或將基因編輯後的 RNA 載體注射至細胞質(右),載體在受精卵階段均可轉錄成 RNA 及轉譯成蛋白質編輯工具。圖片提供/作者
幹細胞研發
身體組織器官內具有體幹細胞,可進行更新或修補,不過體幹細胞已分化,僅能再分裂及分化成該特性組織或器官。唯獨早期囊胚中的內細胞群(inner cell mass, ICM)可分化為身體所有組織及器官,因此,使用囊胚進行培養,使其在體外培養持續保持全能分化潛力及無限分裂特性,即稱為胚胎幹細胞。自 1981 年小鼠(mouse)的胚胎幹細胞被發表後,便在基礎生物學及醫學領域被學者廣為研究,雖然在大鼠(rat)、人類和非人靈長類等物種陸續建立,但在豬的建立截至目前尚未成功。2006 年,日本山中伸彌(Shinya Yamanaka)團隊發表以最少 4 個轉錄因子,分別是 Oct4、Sox2、c-Myc 及 Klf4,使已分化體細胞恢復為具多能分化能力的誘導型多潛能幹細胞。此研究也引領甚多學者陸續發表以豬體細胞成功建立 iPSC,然而,目前僅韋斯特(Franklin D. West)教授團隊在 2010 年所發表的嵌合豬和 2011 年發表具性腺傳承的結果;其他學者儘管能證實所建立的 iPSC 具分化為內、中及外胚層組織的能力,但均無法重複嵌合豬,甚至再增加其他轉錄因子也未能有所突破。不過,豬隻的初代細胞(primary cell)再經 4、5 個轉錄因子誘導培養,如今已普遍可獲得 iPSC,只是在應用上仍存在許多挑戰和限制。
基因編輯豬
基因編輯技術快速發展,包括鋅指核酸酶(zinc finger nuclease, ZFN)、轉錄活化態作用核酸酶(transcription activator-like effector nuclease, TALEN)及 CRISPR/Cas9 等,目前已普遍應用到不同物種,以滿足各種研究開發目的。
這 3 種基因編輯載體所依據的生物原理不同,不過共同特點是精準的將雙股 DNA 切斷,使產生雙股斷裂(double-strand breakage, DSB)。而細胞為存活,必須立即啟動 DNA 修復機制,迅速將斷點重新接黏,因而產生非同質性末端接粘(nonhomologous end jointing, NHEJ),此一修補錯亂中使非原有 DNA 序列插入(insertion)或原有 DNA 遺失(deletion),造成基因編碼錯亂喪失功能,產生基因剔除現象。不過,此技術也存在脫靶現象(off targeting)的風險,也就是在非預期位置產生編輯,破壞非預期基因與其功能。目前,因 CRISPR/Cas9 有著載體構築簡易及降低脫靶現象,已成為此發展的主流技術。
透過油壓或機械傳動控制顯微注射針刺,將基因編輯載體注射至胚內原核(圖一左)或細胞質內(圖一右),即完成載體傳送工作,再由載體自行尋找標的 DNA 進行編輯,此等胚再經由胚移置,植回代理孕母輸卵管內,待完成懷孕產子後,篩選出生家畜即可成功獲得基因編輯的個體。圖二、三和四為臺灣首例以 TALEN DNA 載體、CRISPR/Cas9 DNA 載體及 CRISPR/Cas9 RNA 載體產製的基因剔除豬。

▲圖二:以原核顯微注射 TALEN DNA 載體的基因剔除豬。圖片提供/作者

▲圖三:以原核顯微注射 CRISPR/Cas9 DNA 載體的基因剔除豬。圖片提供/作者

▲圖四:以受精卵細胞質顯微注射 CRISPR/Cas9 RNA 載體的基因剔除豬。圖片提供/作者
生物醫學的應用
如前所述,豬在營養代謝及生理功能極接近人類,在醫藥或醫療器材上市前,可使用豬作為臨床前試驗動物,證明其安全、有效及可接受副作用。由於基因編輯的精準性,現今已有科學家研發將人類的血清白蛋白質(serum albumin, SA)基因,置放在豬血清白蛋白質的基因座上,讓該豬隻不分泌豬血清白蛋白質而只分泌人類血清白蛋白質,以生產醫藥蛋白質。此外,豬的解剖構造及生理功能,是除非人靈長類外,堪稱最接近人類的物種,且有一胎多生、世代間距短,約 6~7 個月齡即可達性成熟的特性,有利基因編輯或基因轉殖的進行,甚至是結合 iPSC 及囊胚代償(blastocyst complementation)等發展,有機會藉由豬隻生產出人類組織器官。此等生物醫學用途發展,下述僅就實驗動物、醫材及異種器官等研發和現今引發的問題做簡單介紹。
(1)實驗用模式動物
在幹細胞研究中,常將細胞埋植在嚴重複合型免疫缺損(severe combined immunodeficiency, SCID),也就是缺乏免疫細胞的小鼠皮下組織,以測試幹細胞的分化發育能力,能否發育成具三胚層組織的畸胎瘤(teratoma),然而因受限體型小,較難有足夠採樣做詳盡分析。所以,利用基因剔除技術產出缺乏免疫細胞的豬,更適合做為 iPSC 研發的實驗動物。不過,也因缺乏免疫功能保護,需要飼養在無病原菌環境,其維持成本則更昂貴。
另外還有其他疾病的應用,像是治療第二型糖尿病藥物產生心血管疾病副作用、阿茲海默症、乳癌、心血管疾病、囊性纖維化、糖尿病和肌肉萎縮症等,均可藉由基因轉殖或剔除豬作為實驗動物進行研究。
(2)相容性醫材及器官移植
現代移植醫學長足進步,病患可藉由組織修補或器官移植,以延續生命並提升健康及生活品質,但因人類同種器官來源不足,使科學家尋求異種來源的組織及器官。目前,科學家也嘗試在豬隻進行基因體修飾以克服超急性、急性及細胞性免疫排斥反應等。不過,除少數案例外,目前均停留在臨床前恆河猴、馬來猴或狒狒試驗,移植後存活日數進展分別為胰島超過 675 天、眼角膜超過 933 天、神經元超過 548 天、心臟異位移植達 945 天、腎臟達 499 天,肝臟及肺臟則僅分別 29 及 8 天。前述恆河猴、馬來猴及狒狒屬於舊世紀靈長類,在演化上,牠們和人類的半乳醣轉移酶基因都已突變無功能,但是合成乙醇基唾液酸基因(NGNA)則未如人類已突變,因此,若能產製出剔除雙重基因的豬隻進行器官移植,效果應該會比現今動物試驗更佳。甚至,使用這些豬隻的醫材移植,會有更高生物相容性。
此外,已有以豬隻組織進行治療的臨床應用,如心臟瓣膜移植;在國內,亦有生技公司以一般豬隻腸膜及眼角膜為材料,開發醫材並取得藥證。在農科院未發表的試驗中也證實克服非蛋白質抗原反應的豬隻,其相關醫材有更高的生物相容性。
(3)囊胚代償與組織應用
前述的 iPSC 除了在臨床細胞治療已進入試驗外,2010 年,日本中內啓光(Hiromitsu Nakauchi)團隊在缺乏 Pdx1 基因的小鼠囊胚中注射大鼠 iPSC,相對於未注射 iPSC 的小鼠因缺少胰臟無法存活,注射大鼠 iPSC 的小鼠胰臟則完全由大鼠的細胞所組成,此現象為囊胚代償作用。發現此現象後,科學家也想進一步利用缺乏 Pdx1 基因的豬胚注入人類 iPSC 的代償作用,期望可客製化糖尿病患者的胰臟,甚至是腎臟和肺臟等,以避免異種移植的排斥反應。
不過,進行人類 iPSC 與動物胚嵌合試驗,也引起倫理道德爭議。主要疑慮在於嵌合豬是否具有人類知覺、外觀或人類細胞是否移至豬性腺。在人類知覺方面,由於人類的孕期是 280 天,豬則為 114 天,人類神經元細胞需要較長懷孕期及哺育期發育成完整大腦結構和功能,仔豬出生後在臍帶斷即可走動、進行吮乳及正常活動,因此,以比較生物發育差異,嵌合豬出生後人類 iPSC 就算移至豬隻腦部,也不足以具有類似人類知覺。在產生人類外觀方面,機率也很低,可藉由減少使用人類 iPSC 數,如注射少於 1% 的 iPSC 與豬胚進行嵌合,配合懷孕診斷並進行監控。
在生殖細胞發育方面則門檻更高,獅子和老虎或馬和驢子配種,所生獅虎和騾子均無繁殖力,山羊與綿羊僅差一對染色體也無法互配繁殖後裔,更不用說染色體差異更大的豬(19 對)和人類(23 對)。科學家也曾利用倉鼠卵鑑定人類精子受精活力,精子在進入倉鼠卵後無法激發卵分裂發育,因此,人類的 iPSC 是無法參與豬隻性腺發育。
整體而言,上述三方面風險除機率極低外,目前科學發展亦設自殺基因(MIXL1)防範,當 iPSC 參與不正確位置發育時,會誘發此基因表達,使細胞自行死亡。此外,在進行人類 iPSC 與基因缺陷豬囊胚進行嵌合試驗前,科學界亦嘗試以猴子 iPSC 與基因缺陷豬胚進行嵌合試驗,評估可能風險及釐清相關疑慮。
結語
在生物醫學領域,iPSC 及基因編輯極具學術及醫學價值,甚至在農業應用亦如是,不過歐盟最高法庭,經 10 年論辯後,在 2018 年 7 月 25 日做出基因編輯屬於基因改造(gene modification, GM)的判決,甚至在歐盟已有反對基因編輯研發的聲音。
是否為基因改造生物(GMO),一般可依製程基礎(process base)或產物基礎(product base)進行判定。以製程基礎論述,基因改造是將外源 DNA 逢機插入宿主基因體內,而基因編輯則是依照設計、精準地剔除或編修內源基因,無外來 DNA 植入(knock in, KI)。就算在基因編輯時一併進行植入,也是將 DNA 精準地放在指定位置,而非逢機嵌插。
以產物基礎論述,基因編輯在未殖入 DNA 片段時,一如生物自然產生突變,而不同於 GMO 攜帶外源基因並表現其產物。此外,目前基因編輯使用 DNA 或 RNA 核酸載體工具,均是由碳、氫、氧、磷和氮等元素組成之有機化學物質,尤其 RNA 在細胞或胚內極不穩定,短暫時間內達成任務後隨即遞解,不會嵌插至宿主基因體內,其誘變過程類似紫外光、輻射、同位素等物理因素或傳統育種使用化學誘變劑所產生突變。所用的核酸在體在環境也會自然分解,不會累積或沉積,甚至比傳統育種所使用的化學誘變藥物更安全。
雖然基因編輯有脫靶現象,非完全精準,要應用在人類醫學、進入臨床試驗前,必須經過仔細及嚴謹的設計、測試及分析篩選。不過,整體而言,iPSC 及基因編輯是當今最具應用潛力科技,值得以更開放心胸,讓科學在嚴謹試驗中往前推展,造福人類。
延伸閱讀
1. 杜清富,〈新興生技在異種移植之應用及進展〉,《農業生技產業季刊》第 45 期 46-54 頁,2016 年。
2.Bourret R, et al., Human-animal chimeras: ethical issues about farming chimeric animals bearing human organs, Stem Cell Res. Ther., Vol. 7: 87, 2016.
⇠上一篇:基因編輯在表觀遺傳修飾中的應用





















