巧妙地讓免疫系統不傷害自己的細胞?
陳斯婷/陽明交通大學臨床醫學研究所副教授,致力於人體執行免疫力及發炎性疾病的機轉探討。折服於人體免疫系統的精妙運作,嘗試從各種角度探索免疫反應。
![]()
✤ 2025 年諾貝爾生理學或醫學獎由布倫科、拉姆斯德爾和坂口志文獲得,他們發現免疫系統如何避免攻擊自己,揭開自體免疫疾病的關鍵機制,為免疫治療帶來新希望。
✤ 1982 年,坂口志文透過小鼠實驗,發現將胸腺細胞提供給被切除胸腺的小鼠,竟然可以防止原先因切除胸腺而引發的自體免疫疾病,爾後發現正是一命名為 Treg 的調節性 T 細胞能夠抑制具有破壞性的T細胞,保護自身細胞不受攻擊。
✤ 2001 年,來自美國生技公司的兩位研究員布倫科與拉姆斯德爾發現了 FoxP3 基因突變的小鼠會嚴重的自體免疫疾病,隨後證明 FoxP3 正是調節 Treg 的數量與發育的關鍵因子。
![]()
2025 年的 10 月 6 日,位於瑞典的卡羅琳斯卡學院(Karolinska Institute)宣布將諾貝爾生理學或醫學獎頒給美國學者瑪麗‧布倫科(Mary Brunkow)、佛瑞德‧拉姆斯德爾(Fred Ramsdell)以及日本大阪大學教授坂口志文,以表彰他們在「周邊免疫耐受性」(peripheral immune tolerance)的開創性發現。三位學者透過細胞與分子機轉揭示了免疫系統是如何防止傷害自身的組織,也確立了自體免疫疾病的關鍵調節機制。這些研究無疑地為免疫治療開啟全新的方向。

▲ 圖一:2025 諾貝爾生理學或醫學獎由布倫科、拉姆斯德爾和坂口志文獲得。圖片來源/Nobel Prize, Facebook
免疫系統的自我控制與耐受性
人體的「適應性免疫反應」(adaptive immune response)以專一性辨識及「辨別敵我」而著稱,其中 T(T cell, T lymphocyte)與 B(B cell, B lymphocyte)兩種細胞能夠針對抗原進行專一性的反應。CD4+ 輔助型 T 細胞(T helper cell, Th)會在辨識特定抗原後,啟動 CD4+ 的活化現象像是釋放細胞激素,協助 B 細胞活化與成熟;CD8+ 毒殺型 T 細胞(T killer cell, TC)則是辨識特定抗原後啟動專一性的細胞毒殺作用,殲滅有表現此特定抗原的細胞。透過這樣的機制將免疫反應控制在克制的範圍內避免傷及不相干的細胞。然而免疫細胞究竟是如何如此準確地辨別敵我呢?約在 1980 年代末期,科學家已經知道,免疫系統在初始發育的過程中,透過在胸腺(thymus gland)的器官執行正向與負向選擇(positive and negative selections),藉此機制獲得不會辨識自體抗原的 T 細胞,也就是中樞耐受機制(central tolerance)。
因為辨識自體抗原的 T 細胞會因為與自身抗原的親和性太高而在胸腺中被清除。剩下這些沒有被清除的 T 細胞則會在胸腺內發育,成熟後的 T 細胞離開胸腺,進入到「周邊」(peripheral)免疫系統成為只能辨識外來病原的防禦細胞。儘管中樞耐受機制精密地調節免疫系統辨別敵我的能力,然而百密必有一疏,有些對自身具有反應性的細胞仍有機會逃逸到血液循環中,也使得這些 T 細胞具有潛在攻擊自體細胞或是不受控制地產生細胞發炎激素的危險性。這些現象會引發自體免疫疾病,例如第 1 型糖尿病(type 1 diabetes mellitus)或多發性硬化症(multiple sclerosis)。
坂口志文發現免疫第二層防線
1982 年,坂口志文的博士論文研究發現切除新生老鼠的胸腺會使老鼠發展出自體免疫性卵巢炎,透過給予正常成年雌鼠的脾細胞或胸腺細胞能防止被切除胸腺的老鼠發展出自體免疫疾病。這個結果成為首次指出在胸腺中,可能存在著一種能夠抑制針對卵巢抗原自體反應的細胞,阻止自體免疫性卵巢炎的發生。當時坂口志文尚未釐清這群在胸腺內且可以抑制免疫反應的細胞是哪一種特定的族群。直到 1995 年坂口志文團隊發現一種名為 IL-2 受體 A 鏈的分子(CD25),會表現在周邊 CD4+ T 細胞中,且約有 10% 的 CD4+ T 細胞能共同表達 CD25(也就是 CD4+CD25+ T 細胞),而在周邊的 CD8+ T 細胞約有少於 1% 的 CD8+ T 細胞能共同表達 CD25(也就是 CD8+CD25+ T 細胞)。坂口志文團隊透過無胸腺裸鼠的研究模型發現在給予這些老鼠不含 CD25 表現的 CD4+ T 細胞(CD4+CD25-)時,這些沒有胸線的老鼠皆自發性地發展出組織學與血清學上可明顯觀察到的自體免疫性疾病(例如甲狀腺炎、胃炎、胰島炎、唾液腺炎、腎上腺炎、卵巢炎、腎小球腎炎及多關節炎);部分小鼠甚至出現了類似移植物抗宿主病(graft-versus-host disease, GVHD)的疾病表現(圖二)。這些老鼠可以在一段有限時間內再補充 CD4+CD25+ 細胞後預防這些自體免疫性疾病的發展。相反地,當再補充的細胞是 CD8+ 細胞,預防效果則顯著降低。這個有趣的現象讓坂口志文團隊大為驚喜,也為該篇論文結論幾個大膽的結論:
(1)CD4+CD25+ 細胞可透過在抗原非特異性的方式下,於 T 細胞活化階段抑制對自身與非自身抗原的免疫反應,以維持自體耐受性。
(2)當 CD4+CD25+ 細胞被消除或減少時,這種普遍性的免疫抑制作用就會被解除,因而增強了對外來抗原的免疫反應,也誘發對某些自身抗原的自體免疫反應。
(3)這種由 T 細胞介導的周邊免疫耐受機制的異常,可能是多種自體免疫疾病的潛在原因。
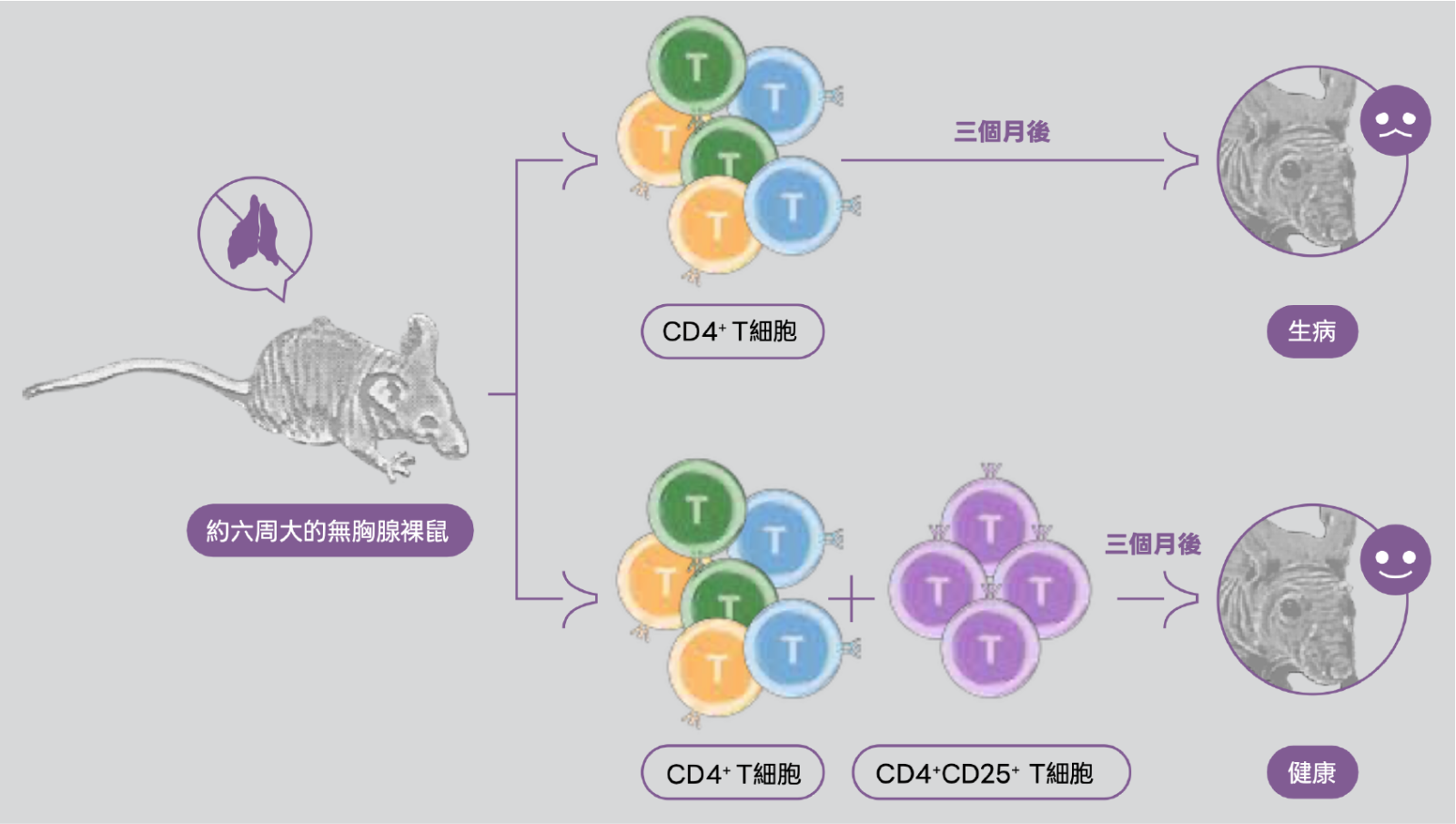
▲圖二。圖片提供/本文作者
長久一來,科學家一直認為中樞耐受機制是免疫系統獲得自體耐受(self-tolerance,也就是免疫系統能分辨「自己」和「外來者」,並避免攻擊自身組織的能力)的唯一途徑。然而坂口志文團隊卻提出,儘管 T 細胞成熟後來到周邊循環甚至進入其他的器官與組織,免疫系統仍然能透過 CD4+CD25+ T 細胞的策略來阻止不應該被活化的 T 細胞。這篇論文於 1995 年發表在美國免疫學期刊,這是一個相當震撼的新觀念,也使當年提出此想法的坂口志文團隊受到許多當時主流免疫學家的攻擊與駁斥。在論文發表的當下,這群細胞也沒有給予相對應的命名,事隔多年後,因為坂口志文團隊對於研究的堅持以及來自其他研究團隊也證實坂口志文的研究結果,2000 年,坂口志文正式在「細胞」雜誌發表文章,正式命名這群表現 CD25 的蛋白且具有抑制其他具破壞性的 T 細胞為「調節性 T 細胞」(regulatory T cells, Treg)。截至目前為止,這篇論文已獲得一萬多次專業論文引用,顯示 Treg 細胞存在的事實以及它對於免疫調節機制的重要性。
調節「調節性 T 細胞」的關鍵基因
2001 年,美國華盛頓州波瑟爾的生物技術公司 Celltech Chiroscience 中的兩位研究員——布倫科與拉姆斯德爾找到了第二個關鍵線索。他們研究一群被稱為 scurfy 的突變小鼠,這種小鼠會出現嚴重的自體免疫疾病,牠們的半合子(hemizygote)雄鼠 註 會在出生後 16~25 天內死亡。而且小鼠會出現 CD4+CD8- T 淋巴球的過度增生、多重器官浸潤以及多種細胞激素上升的特徵。兩位學者結合高解析度的遺傳與物理定位技術以及大規模序列分析,鑑定出 scurfy 小鼠中的這些症狀源自 X 染色體上一個先前未知的基因缺損,並將該基因命名為 FoxP3。
FoxP3 是一種 forkhead/winged-helix 家族的轉錄調控因子,蛋白產物稱為 Scurfin,對維持免疫恆定(immune homeostasis)至關重要。FoxP3 在人體中序列高度一致,研究團隊也進一步證實當人類的 FoxP3 基因發生突變時,會導致兒童早發且產生致命的疾病,例如罕見的自體免疫疾病——IPEX 症候群(Immunodysregulation polyendocrinopathy enteropathy X-linked syndrome,免疫失調、內分泌異常與腸病綜合症)。兩年後,坂口志文成功地將他所發現的 CD4+CD25+ T 細胞與 FoxP3 基因的研究連結。他證明 FoxP3 基因正是控制 Treg 細胞發育,也是維持 Treg 細胞在周邊數量的關鍵因子。當小鼠缺乏 FoxP3 基因則無法正常生成 CD4+CD25+ T 細胞族群,也直接影響免疫恆定並且出現自體免疫疾病的症狀(圖三)。
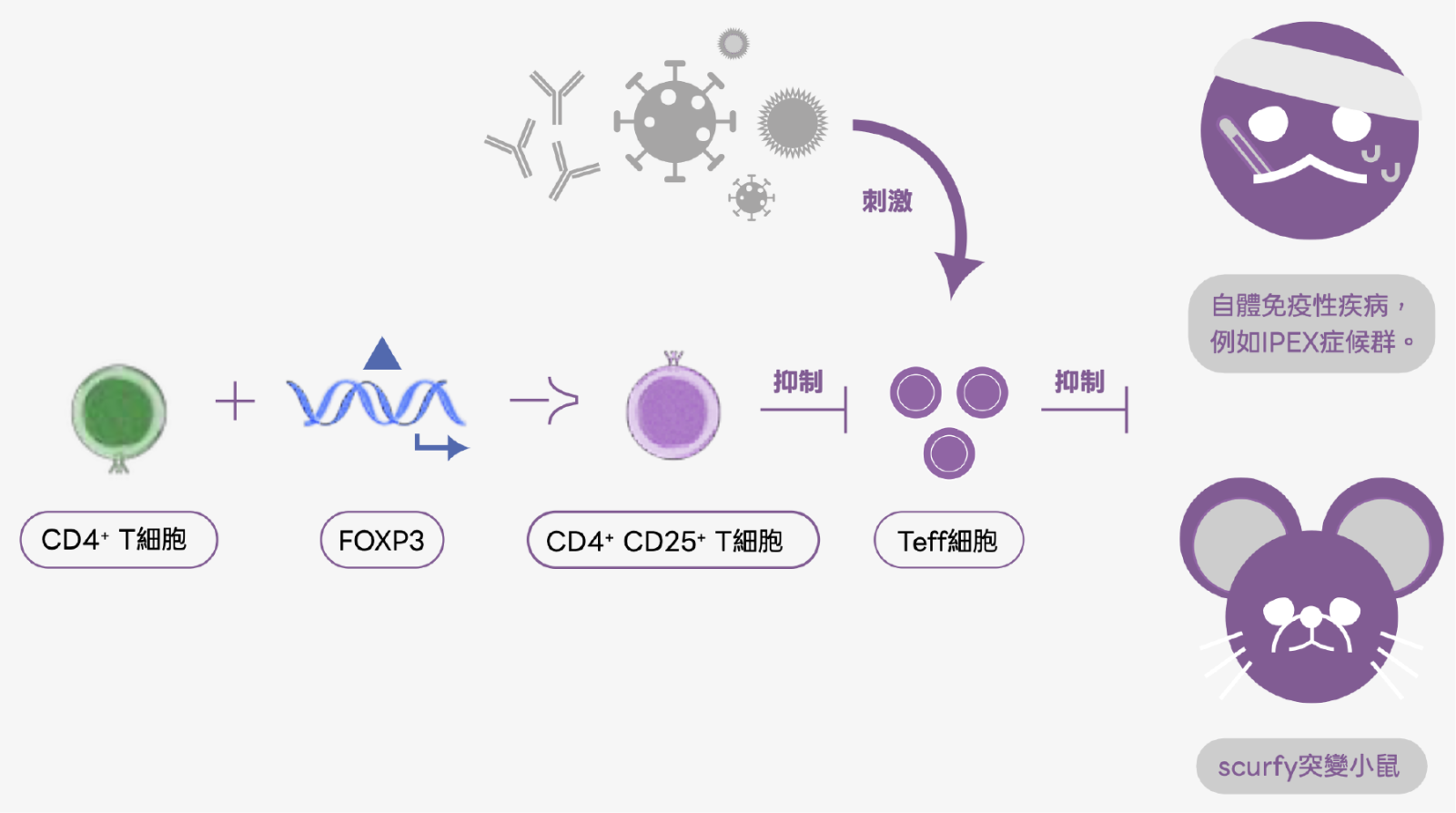
▲圖三:當 CD4+ T 細胞導入 FOXP3 轉錄子並表現後,便會分化成為 CD4+CD25+ T 細胞(也就是 Treg),而 Treg 會進一步抑制因自體抗原或外來病原刺激而誘發的 Teff 細胞,而進一步抑制生物體產生自體免疫疾病,此現象都已在人類和 scurfy 的突變小鼠身上證實。圖片提供/本文作者
調節性 T 細胞的作用機制
我們的免疫系統每天都在抵禦成千上萬試圖入侵的微生物。這些外來者外貌各異,甚至更進化出模仿人體細胞抗原的「偽裝術」。另外,當體內受損的細胞釋出許多蛋白及核酸物質被樹突狀細胞吞噬後並且呈現給 T 細胞,這些抗原都是原始 T 細胞在胸腺環境中所沒有遇過的抗原,因此自然不會對這些自體的抗原產生耐受性。因此當 CD4+ T 細胞或 CD8+ T 細胞辨識到這些抗原且同時啟動活化的機制時(以下稱為 T effector cells, Teffs),而緊接著 Treg 細胞會立刻感知到 Teffs 處在活化的起始階段,經由 Treg 細胞自身的 T 細胞受體(T cell receptor, TCR)訊息,迅速啟動轉錄因子 AP-1 並與 Teffs 同步活化。活化的 Treg 細胞則可透過細胞間交互作用或消耗環境中的 IL-2 細胞激素,或是釋放 IL-10,IL-35 及 TGF-beta 細胞激素來抑制周圍活化的 Teffs 來達到免疫抑制的效果。Tregs 能透過抗原特異性或抗原非特異性的方式抑制自體反應性的 Teffs,例如針對病原菌感染可在免疫反應的早期就與調節機制同步運作減少過度的免疫反應控制,以確保免疫系統不會傷害自身組織。
臨床應用的啟發
諾貝爾委員會主席康培(Olle Kampe)提到:「三位學者的發現使我們對於理解免疫系統的運作及如何維持體內恆定具有決定性影響。」這樣的運作更是說明為何並非所有人都罹患嚴重自體免疫疾病。這些發現已推動多項潛在治療的開發。目前正在進行臨床試驗,以增加 Treg 細胞的數量,來抑制自體免疫疾病或器官移植後的不良免疫反應。坂口志文也協助推動臨床應用,他於 2016 年與夥伴創立醫療創新公司 RegCell,目標是從根本上改變自體免疫疾病的治療方式。RegCell 希望透過坂口志文大量的開創性研究成果,讓病人恢復能夠區分自我和非我有效且長期的方法,使免疫系統重新具備正常功能與平衡。另外 Treg 細胞也讓癌症治療的策略出現新的曙光。因為癌細胞能改變腫瘤微環境的免疫調節活化 Treg 細胞,而藉此逃避正規的免疫反應使癌細胞免於被毒殺型 T 細胞清除。因此,癌症治療的重點可以放在如何下調或破壞這些 Treg 細胞,讓免疫系統得以對抗惡性細胞。儘管我們對 Treg 細胞仍有許多未知,如何在臨床上常規利用這些細胞及特性來改善疾病的狀況也仍在研究階段。不過這項研究的確為整個免疫學的領域開了一扇大門,讓調節型T細胞的轉譯研究改變傳統的免疫治療模式。 註 :在二倍體生物中,某個基因在一對同源染色體上不成對出現,只存在於其中一條同源染色體上,另一條上沒有與其對應的等位基因。
註 :在二倍體生物中,某個基因在一對同源染色體上不成對出現,只存在於其中一條同源染色體上,另一條上沒有與其對應的等位基因。
延伸閱讀
1. Sakaguchi, S.et al., (1982). Study on cellular events in post-thymectomy autoimmune oophoritis in mice. II. Requirement of Lyt-1 cells in normal female mice for the prevention of oophoritis. Journal of Experimental Medicine, 156(6), 1577–1586.
2. Sakaguchi, S.et al., (1995). Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25): Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. Journal of Immunology, 155(3), 1151–1164.
3. Brunkow, M. E.et al., (2001). Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nature Genetics, 27(1), 68–73.
⇠上一篇:
創新的低碳建材,木構造建築新時代:下一篇⇢
本文轉載、修改自《科學月刊》2025 年 12 月
















